Современные представления о строении атома. Для квантовомеханического описания атома необходимо решить уравнение Шредингера
Для квантовомеханического описания атома необходимо решить уравнение Шредингера. Эта достаточно непростая задача успешно решена для атома водорода и водородоподобных ионов.
Согласно квантовой механике, энергия электрона в атоме, его орбитальный момент импульса, проекция момента импульса на выделенное направление в пространстве и проекция собственного момента импульса электрона (спина) на это направление дискретны или квантованы.
Состояние электрона в атоме описывается набором четырех квантовых чисел: n, l, m и s.
n называется главным квантовым числом и характеризует энергию электрона в атоме:

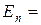 −
− 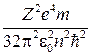 . (2.9.4)
. (2.9.4)
Орбитальное число l характеризует момент импульса электрона в атоме:
L = 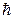
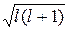 . (2.9.5)
. (2.9.5)
Магнитное число m определяет проекцию момента импульса на выделенное направление в пространстве (например, на направление магнитного поля):
Lz = 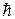 m. (2.9.6)
m. (2.9.6)
Электрон и ряд других элементарных частиц обладают собственным механическим моментом импульса (спином), не связанным с их движением в пространстве. Спиновое число s характеризует проекцию момента импульса электрона на выделенное направление в пространстве.
При переходе с одного энергетического уровня (Em) на другой (En) атом испускает или поглощает квант энергии электромагнитного поля (фотон)
hn=Em – En. (2.9.7)
Квантовомеханическое описание многоэлектронных атомов является еще более трудной задачей, нежели описание атома водорода. В многоэлектронных системах проявляются особые свойства, не имеющие аналогов в классической физике. В классической механике частицы, обладающие одинаковыми физическими параметрами (масса, электрический заряд, размер и др.), принципиально можно различить по их положению в пространстве и импульсам. Такие частицы называются тождественными. Волновые свойства микрообъектов приводят к тому, что тождественные микрочастицы принципиально неразличимы. Для микрочастиц неприменимо понятие траектории, состояние микрочастицы описывается волновой функцией, квадрат модуля которой позволяет вычислять лишь вероятность нахождения микрочастицы в окрестности той или иной точки пространства. В области перекрытия волновых функций вопрос об индивидуальности той или иной частицы лишен смысла. Принцип неразличимости тождественных частиц является одним из фундаментальных принципов квантовой механики.
Принцип неразличимости тождественных частиц приводит к особым чертам в поведении электронов в многоэлектронных атомах. Эти особенности сконцентрированы в принципе, сформулированном В. Паули (1925): в атоме не могут находиться два электрона, обладающих одинаковым набором квантовых чисел. Согласно принципу Паули, у любых двух электронов в атоме не может быть четырех одинаковых квантовых чисел (главное n, орбитальное l, магнитное m и спиновое s), значения по крайней мере одного квантового числа должны различаться.
Принцип Паули лежит в основе заполнения электронных состояний в атоме и объясняет Периодическую систему элементов Д.И. Менделеева.
Дата добавления: 2016-01-26; просмотров: 896;
