Развитие представлений о строении атома
Атомистическое учение возникло еще в античные времена. Великие древнегреческие философы (Демокрит, Эпикур, Лукреций) рассматривали атомы как первокирпичики мироздания (“атомос”– неделимый, неразложимый). В средние века атомистическое учение, являясь по своей сути материалистическим, не могло получить своего признания и развития. Ситуация изменилась к началу XVIII века, в трудах А. Лавуазье, М. Ломоносова, Д. Дальтона была доказана реальность существования атомов. Однако вопрос о внутреннем строении атома в то время даже не поднимался.
Первая попытка создания модели атома принадлежит Дж.Дж. Томсону (1903). Согласно этой модели атом представляет собой непрерывно заряженный положительным электричеством шар, внутри которого колеблются электроны. Эта модель была опровергнута опытами Э. Резерфорда по рассеянию α-частиц.
Э. Резерфорд предложил ядерную (планетарную) модель атома. Эта модель основана на аналогии с Солнечной системой. В центре атома находится положительно заряженное ядро, вокруг которого по замкнутым орбитам вращаются электроны. Заряд ядра равен суммарному заряду электронов, поэтому атом электрически нейтрален. Эта модель оказалась электродинамически неустойчивой и противоречила опытным данным.
Исследования спектров разреженных атомов (т.е. спектров излучения изолированных атомов) показали, что каждому газу присущ вполне определенный линейчатый спектр, состоящий из спектральных линий или групп близко расположенных линий. Самым изученным является спектр атома водорода. Все линии спектра атома водорода могут быть описаны формулой Бальмера:
n = R 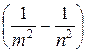 , (2.9.1)
, (2.9.1)
где n – частота спектральных линий в спектре атома водорода, R – постоянная Ридберга, m и n – целые числа.
Исследования более сложных спектров показали, что в расположении их линий тоже есть закономерности, только более сложные.
Формулы, описывающие положение спектральных линий, были подобраны эмпирически (т.е. опытным путем) и долгое время не имели теоретического объяснения. Удивительная повторяемость в формулах целых чисел, универсальность постоянной Ридберга свидетельствует о глубоком физическом смысле найденных закономерностей. Вскрыть эти закономерности в рамках классической физики не удалось. Выйти за рамки классических представлений попытался Н. Бор, работы которого явились важнейшим этапом развития представлений о строении атома.
Бор постулировал принципиально новые положения:
1 В атоме есть стационарные круговые орбиты, двигаясь по которым, электрон не излучает и не поглощает энергию. Моменты количества движения pj этих орбит удовлетворяют условию
pj = 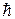 n (2.9.2)
n (2.9.2)
где pj = mr2w и n – любое натуральное число (n = 1, 2, 3…..).
2 Электрон при переходе с одной орбиты на другую излучает или поглощает квант энергии, при этом выполняется закон сохранения энергии:
hn = En – Em.(2.9.3)
Здесь En и Em – энергии стационарных состояний атома до и после перехода.
Существование энергетических уровней атомов было экспериментально подтверждено в опытах Франка и Герца (1913).
Таким образом, теория Бора объяснила линейчатый спектр атома водорода. Однако по Бору нельзя рассчитать интенсивность линий спектра, описать многоэлектронные атомы. Будучи крупным шагом в развитии атомной физики, теория Бора тем не менее обладала внутренними противоречиями. Отвергая классические представления, теория Бора не стала последовательной квантовой теорией. Дальнейшее познание микромира стало возможным только с созданием квантовой механики.
Дата добавления: 2016-01-26; просмотров: 1260;
