СПОСОБЫ КРУПНОМАСШТАБНОГО ПРОИЗВОДСТВА ВОДОРОДА
По мнению многих ученых, наиболее перспективным и универсальным энергоносителем и топливом будущего может служить водород. Неоспоримым преимуществом водорода перед другими видами топлива служит то, что: 1) сырьем для производства водорода является вода и, следовательно, его ресурсы практически неограничены и возобновляемы, так как при горении водород снова превращается в воду; 2) водород — идеальное горючее с экологической точки зрения; единственным продуктом его сжигания является вода; 3) водород — уникальное сырье химической промышленности, металлургии, нефтепереработки, в том числе для таких крупнотоннажных производств, как синтез аммиака и метанола, для которых водород — основной исходный реагент; 4) молекулярный водород обладает высокой теплотой сгорания, равной 125,5 МДж/кг, почти в 4 раза большей, чем углерод (32,8 МДж/кг); 1 кг водорода содержит также в 3 раза больше энергии, чем 1 кг высококачественного бензина (40,3 МДж/кг); 5) водород можно транспортировать на любое расстояние, используя существующую систему газопроводов; при этом благодаря низкой плотности и вязкости водорода можно повысить объем транспортируемого газа в тех же газопроводах; 6) водород можно хранить в сжиженном виде либо аккумулировать в виде гидридов; 7) применение водорода в существующих авиационных и автомобильных двигателях не требует их существенного изменения. То же относится к применению водорода в бытовых отопительных установках и приборах. Однако производство водорода существующими методами обходится дорого и его применение в качестве транспортного и энергетического топлива пока не экономично. Поэтому разрабатывают принципиально новые способы крупномасштабного производства водорода.
При широком применении водорода как энергоносителя и топлива могут возникнуть осложнения, а именно: 1) плотность водорода в 8 раз меньше плотности природного газа и поэтому его объемная теплоемкость в 3,3 раза ниже. Это основное препятствие для применения чистого водорода в транспортных двигателях. В существующих гидридах доля водорода пока не более 2% от массы гидрида. Разрабатывают гидриды с повышенным содержанием водорода, а также приемы транспортировки, хранения и применения жидкого водорода в автомобильных, авиационных и ракетных двигателях; 2) температура сжижения водорода при атмосферном давлении (—253°С) ниже, чем природного газа (метан — 165°С). При хранении в жидком виде может происходить значительная утечка водорода. Но испарение жидкого водорода можно резко снизить, применяя многослойную изоляцию стен хранилищ и трубопроводов.
Поскольку стоимость водорода пока много выше, чем нефтепродуктов, его внедрение взамен нефтепродуктов начато с добавок к автомобильному топливу. Установлено, что добавка водорода в количестве 5—10% к основному топливу в значительной мере снижает вредные выбросы автотранспорта, одновременно повышая экономичность и устойчивость работы двигателей; экономия горючего достигает 40%. Сейчас во многих странах предусмотрены добавки водорода и метанола в автомобильный бензин для снижения потребления нефтепродуктов и токсичности выбросов. Метанол — одно из производных водорода — получают из синтез-газа.
В химической промышленности водород давно используется и последует лишь расширение масштабов его применения. Сейчас водород широко применяют для получения азотоводородной смеси (синтез аммиака), для процессов ароматизации, риформинга, гидрокрекинга, гидрирования нефтепродуктов, гидрогенезации и гидрогазификации углей и ряда других восстановительных процессов в промышленности.
В настоящее время основные промышленные способы производства водорода следующие: 1) конверсия метана природного газа с последующей конверсией полученного оксида углерода (СО); 2) конверсия СО водяного или смешанного генераторного газа газификации твердого топлива; 3) конверсия газа полукоксования бурых углей; 4) разделение коксового газа путем последовательной конденсации всех компонентов, кроме водорода; 5) электролиз воды или водных растворов хлорида натрия.
Методы конверсии летучих продуктов полукоксования и генераторных газов аналогичны методу конверсии метана природного газа, который рассмотрен ниже.
Каталитическая конверсия метана природного газа с водяным паромслужит ведущим методом производства водорода. Первичный продукт конверсии метана — это синтез-газ, который кроме производства водорода используется для получения метанола, высших спиртов, синтетического бензина, синтетической олифы, моющих средств и др. Конверсию метана с водяным паром предполагается применять также для получения восстановительных газов (того же состава, что и синтез-газ) с целью прямого восстановления железа из руд. Сущность метода конверсии заключается в окислении метана и его гомологов водяным паром, кислородом или диоксидом углерода по реакциям:
СН4 + Н2О D СО + 3Н2, DН = +206 кДж (а)
СН4+0,5О2 D СО+2Н2, DН = –35 кДж (б)
СН4 + CO2 D 2CO + 2Н2, DН = +248 кДж (в)
Реакции гомологов метана протекают аналогично, например:
СnН2n+2 + nН2О D nСО + (2n – 1) Н2
Вторичная реакция конверсии оксида углерода с водяным паром протекает по уравнению
СО + Н2О D СО2 + Н2, DН = –41 кДж (г)
Суммарно конверсия метана с водяным паром происходит с поглощением теплоты:
СН4 + 2Н2О D СО2 + 4Н2, DН = +165 кДж
В промышленности применяют каталитическую конверсию метана при атмосферном или повышенном давлении, некаталитическую высокотемпературную конверсию и термоокислительный пиролиз метана. Применение катализаторов увеличивает скорость процесса и позволяет понизить его температуру, поэтому доминирует каталитическая конверсия метана. Равновесная степень превращения и остаточное содержание метана в газовой смеси зависят от температуры, давления и соотношения исходных реагентов пар : газ. При 800 — 1000°С значения констант равновесия реакций (а) и (б) составляют 1,4×104 и 1,6×1011 соответственно и остаточное содержание метана мало. Но скорость достижения равновесия без катализатора при этих температурах еще невелика. Для каталитической конверсии метана применяют никелевый катализатор на носителе — оксиде алюминия, на котором равновесие быстро достигается при 800°С и высоких объемных скоростях парогазовой смеси. Несмотря на то, что с увеличением давления содержание метана в равновесном газе повышается, конверсию метана проводят обычно под давлением, чтобы повысить скорость реакции, уменьшить объем аппаратуры и газопроводов. При этом используется естественное давление природного газа, с которым он подается на завод (1—4 МПа).
Продуктом конверсии метана и его гомологов является синтез-газ, содержащий 10—15% СО (по объему); для получения водорода или азотоводородной смеси требуется дополнительная операция конверсии оксида углерода.
Конверсия оксида углерода с водяным паром протекает по обратимой экзотермической реакции (г) без изменения объема. Поэтому повышение давления увеличивает скорость процесса, не влияя на равновесный выход водорода. Повышение температуры смещает равновесие в сторону исходных продуктов (рис. 1), но при низких температурах мала скорость реакции даже в присутствии катализаторов.
| |
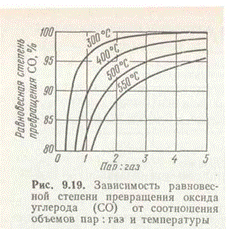
Увеличение содержания водяного пара в исходной смеси повышает равновесный выход водорода Для конверсии оксида углерода применяют железохромовый и цинкхромомедный катализаторы. Железохромовый, промотированный оксидами алюминия, калия и кальция, представляет собой высокотемпературный катализатор, обеспечивающий достаточную скорость конверсии СО только при 450—500°С, когда в конвертированном газе остается не менее 2—4% непревращенного СО. На этом катализаторе проводится первая ступень конверсии. Вторая ступень конверсии осуществляется на низкотемпературном цинк-хромомедном катализаторе до остаточного содержания СО — 0,2–0,4%. Низкотемпературный катализатор несколько более чувствителен к серосодержащим соединениям, чем железохромовый. Теплота реакции используется после первой ступени конверсии для выработки пара в котле-утилизаторе, в результате чего перед второй ступенью катализа температура газа понижается. Конвертированный газ направляется на очистку от СО2, непревращенного СО и серосодержащих соединений. После удаления примесей газ представляет собой водород (если конверсия метана проводилась в отсутствие воздуха) либо азотоводородную смесь для синтеза аммиака.
На рис. 2 приведена принципиальная технологическая схема двухступенчатой конверсии метана природного газа.
| |
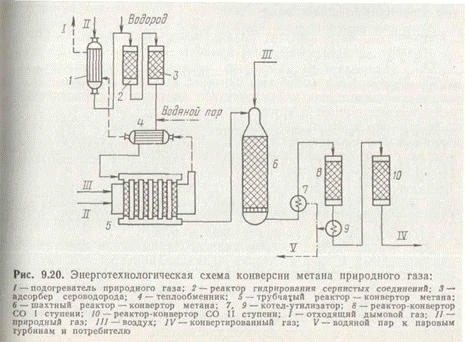
Природный газ под давлением около 4 МПа проходит подогреватель и очистку от серосодержащих соединений каталитическим гидрированием их в сероводород с последующей адсорбцией H2S. Очищенный природный газ смешивают с водяным паром в соотношении пар:газ = 3,7:1, подогревают в теплообменнике ~до 380°С и подают на первую ступень конверсии в трубчатый каталитический реактор; конверсия метана с водяным паром по реакции (а) происходит при 800—850°С в трубках с никелевым катализатором, обогреваемых газами, которые образуются при сжигании части природного газа в топке реактора.
После первой ступени конверсии газ, содержащий 9—10% СН4, смешивают с воздухом и подают на вторую ступень — парокислородную в каталитический реактор шахтного типа. Соотношение пар:газ на второй ступени конверсии составляет 0,8:1, температура 900—1000°С поддерживается за счет теплоты экзотермической реакции (б). Теплота конвертированного газа, выходящего из шахтного реактора, используется в котле-утилизаторе, где вырабатывается пар высоких параметров (10 МПа, 480°С). Для получения азотоводородной смеси синтез-газ, полученный при конверсии метана, передается на двухступенчатую конверсию оксида углерода (см. реакцию (г)) сперва в реактор-конвертор с железохромовым катализатором, затем в котел-утилизатор и далее в конвертор с низкотемпературным цинкхромомедным катализатором. Конвертированный газ подвергают очистке от СО2, СО и О2. В последнее время разработаны варианты включения ядерного реактора в схему конверсии метана для снабжения теплотой реакцию (а), протекающую в трубчатом каталитическом реакторе, взамен сжигания природного газа. С этой целью в межтрубное пространство реактора направляют теплоноситель (гелий), нагретый в ядерном реакторе до ~900°С. Теплота гелия, выходящего из трубчатого реактора при ~700°С, используется далее в газовых турбинах, а также для подогрева исходной парогазовой смеси до 500°С и для получения водяного пара.
Конверсия других углеводородных газов — полукоксования или газификации твердого топлива с целью получения водорода имеет те же теоретические основы и аналогичное аппаратурное оформление.
Разделение коксового газа глубоким охлаждением служит методом получения водорода или азотоводородной смеси для синтеза аммиака. Попутно выделяют этиленовую и метановую фракции, а также фракцию оксида углерода. Эти побочные продукты являются ценным сырьем органического синтеза. Методом глубокого охлаждения можно перевести в жидкое состояние все компоненты коксового газа, кроме водорода.
Перед низкотемпературным разделением коксовый газ подвергают глубокой очистке от высококипящих примесей (Н2О, С6Н6, H2S, СО2, NОх), которые при низких температурах кристаллизуются, блокируя поверхности теплообмена, а также могут образовывать взрывоопасные комплексы (NOх). Разделение коксового газа осуществляется под давлением около 1,3 МПа путем последовательного, многоступенчатого охлаждения с использованием холода выделенных фракций. В результате разделения коксового газа можно получить водород с концентрацией до 97%.
Для перспективных планов широкого применения водорода в промышленных и энергетических целях планируется его крупно-масштабное производство из воды — самого дешевого сырья, запасы которого неограниченны. Существующие и разрабатываемые методы производства водорода из воды делятся на три группы: 1) электролиз воды; 2) термохимические методы и 3) комбинированные термо- и электрохимические методы.
Электролиз — наиболее освоенный метод производства водорода из воды, в настоящее время он используется в небольших масштабах при наличии дешевой электроэнергии.
Термохимический метод получения водорода основан
на разложении воды с помощью тепловой энергии, которую предполагается получать от атомных реакторов с гелиевым охлаждением, используя теплоту газового теплоносителя на выходе из реактора. Непосредственное разложение воды по реакции
2Н2О D 2Н2 + О2
неосуществимо, так как при необходимой для этого высокой температуре (около 1000°С) константа равновесия реакции составляет всего 1,48×10–6, что соответствует парциальному давлению Н2 и О2 в реакционной смеси порядка 10–1 Па. Реализация процесса возможна заменой реакции прямого разложения воды термохимическим циклом, состоящим из нескольких реакций, для каждой из которых значения константы равновесия были бы приемлемы для практики. Разработано и предложено множество термохимических циклов для разложения воды при температурах, доступных с точки зрения использования теплоты охлаждающих газов ядерных реакторов. В большинстве предложенных циклов промежуточные вещества имеют высокое сродство либо к водороду, либо к кислороду — это галогены, элементы VI группы (сера), металлы II группы (Mg, Ba, Са) и переходные элементы с переменной степенью окисления (V, Fe). Ниже приведен один из примеров термохимического цикла реакций, ведущих к разложению веды на Н2 и О2:
|
HgBr2 (ж) + Са (ОН)2 (р) = СаВг2 (р) + HgO (т) + Н2О (ж)
HgO (т) = Hg (т) + 1/2О2 (г)
|
|
Весь термохимический процесс разложения воды представляет собой замкнутый цикл, так как все исходные реагенты отделяются от продуктов реакции и возвращаются в цикл, за исключением воды, расходуемой на образование Н2 и О2. Максимальная температура реакций не превышает 700°С и может быть обеспечена теплоносителем на выходе из атомного реактора на уровне 800— 900°С.
В настоящее время ни один из предложенных термохимических циклов еще не реализован в промышленности и значение КПД циклов, а также расчеты затрат на получение водорода этим методом пока не определены.
Комбинированный методпроизводства водорода заключается в комбинировании термо- и электрохимических стадий процесса. Ожидаемые преимущества комбинированного метода состоят в том, что могут быть использованы достоинства каждого из рассмотренных способов: электрохимический хорошо освоен, имеет простое аппаратурное оформление, а термохимический более экономичен, но мало освоен и включает стадии, трудные для промышленного осуществления. Примером может служить сернокислотный комбинированный цикл получения водорода и кислорода из воды. Это двухступенчатый процесс: первая стадия — эндотермическая реакция, осуществляемая при 900°С:
H2SO4 = Н2О + SO2+ 1/2O2
Вторая – низкотемпературный электрохимический стадия процесс:
2Н2О + SO2 + 2е–= H2SO4 + H2
Реакция может быть реализована только электролизом, так как ее константа равновесия и теоретический выход водорода чрезвычайно малы.
Теоретическое напряжение, требуемое для данной реакции, при 25°С меньше, чем для прямого электролиза воды, и составляет 0,17 В (для электролиза воды (1,23 В) Расчетные затраты для комбинированной установки меньше, чем для электролиза воды. Суммарный КПД процесса должен составить около 35—37%. По мнению специалистов комбинирование термохимических и электрохимических стадий — наиболее перспективное направление крупномасштабного производства водорода из воды.
| <== предыдущая лекция | | | следующая лекция ==> |
| Выход дистиллятов на двухступенчатых атмосферно-вакуумных установках перегонки нефти | | | МЕТОДЫ ФИКСАЦИИ АТМОСФЕРНОГО АЗОТА |
Дата добавления: 2016-01-20; просмотров: 1674;
