При возрастании степени дисперсности
| Длина стороны куба, мм | Число кубов | Поверхность | Длина стороны куба, нм | Число кубов | Поверхность | ||
| суммарная, см2 | на единицу объема, см2/см3 | суммарная, м2 | на единицу объема, м2/см3 | ||||
| 0,1 | 1012 | 6×104 | |||||
| 103 | 6×10 | 0,01 | 1015 | 6×105 | |||
| 0,1 | 106 | 6×102 | 0,001 | 1018 | 6×106 | ||
| 0,01 | 109 | 6×103 | 0,0001 | 1021 | 6×107 |
Большая суммарная и удельная поверхности обусловлены высокой степенью дисперсности, вследствие чего масса коллоидной частицы относительно невелика по сравнению с ее поверхностью, что определяет высокую реакционную способность коллоидов. Удельная поверхность частиц глинистых минералов составляет от 5 до 30 м2/г у каолинита, 50-100 м2/г у иллитов и 600-800 м2/г у монтмориллонита и вермикулита.
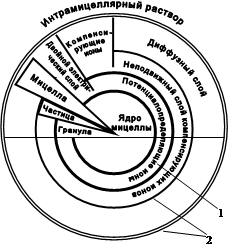
Рис.4. Схема строения коллоидной мицеллы (по Н.И.Горбунову)
1 и 2 – слой отрицательно и положительно заряженных ионов соответственно
|
Строение коллоидов.Наличие двойного электрического слоя ионов является следствием строения коллоидов. Коллоидную частицу, по предложению Вигнера, называют мицеллой (рис.4). Ядро мицеллы состоит из агрегата недиссоциированных молекул того или иного вещества (минерального или органического). На поверхности ядра формируется двойной электрический слой ионов, образующий границу раздела с дисперсионной средой (интрамицеллярным раствором). Этот слой образуется в результате диссоциации внешних молекул самого ядра или вследствие поглощения ионов из дисперсионной среды. Внешний, или диффузный, слой образует рой (облако) ионов, способных к обменным реакциям. В его пределах между неподвижным слоем ионов и дисперсионной средой возникает разность потенциалов вследствие перемещения части противоионов к внешней границе диффузного слоя. Эта разность потенциалов называется z-потенциалом (дзета-потенциал) и обусловливает свободный электрический заряд коллоидной частицы. Величина z-потенциала колеблется от 0 до 40-60 мВ.
В зависимости от состава ионов в потенциалопределяющем слое различают ацидоиды, базоиды и амфолитоиды. Ацидоиды это отрицательно заряженные коллоиды, содержащие анионы в потенциалопределяющем слое и катионы в диффузном. Базоиды – положительно заряженные коллоиды с катионами в потенциалопределяющем слое и анионами в диффузном. Амфолитоидыспособны менять характер диссоциации молекул двойного электрического слоя и в зависимости от реакции среды вести себя как ацидоиды или как базоиды. основная масса коллоидов в почве является ацидоидами, присутствуют также амфолитоиды, меняющие знак в зависимости от рН среды.
Свойства коллоидов. По отношению к жидкой фазе коллоиды делятся на гидрофильные, способные поглощать молекулы воды с образованием на поверхности частицы многослойной пленки (гидратация коллоида), и гидрофобные, практически не гидратирующиеся (не смачиваются водой). К гидрофильным коллоидам относятся, например, минералы монтмориллонитовой группы, а к гидрофобным – каолинитовой.
Коллоиды могут находиться в двух состояниях: золя (коллоидного раствора) и геля (коллоидного осадка). Наличие электрического заряда обусловливает электрокинетические свойства, главнейшими из которых являются коагуляция и пептизация.
Коагуляция – переход коллоида из состояния золя в состояние геля. Коллоиды теряют заряд и слипаются в агрегаты. Причины коагуляции следующие:
· действие электролитов, ионы которых несут противоположный знак заряда;
· взаимодействие двух коллоидных систем с разноименно заряженными частицами;
· дегидратация гидрофильных коллоидов и повышение концентрации электролита в растворе в результате высушивания или замораживания почвы.
Наиболее легко коагулируют гидрофобные коллоиды, труднее – гидрофильные из-за наличия на поверхности водной оболочки. Гели могут быть обратимыми и необратимыми. Коагуляция способствует образованию почвенной структуры, уменьшению связности тяжелых по гранулометрическому составу почв, сохранению от вымывания колллоидов.
Пептизация – переход из состояния геля в золь. Она вызывается восстановлением заряда и повышением z-потенциала коллоидной системы. Пептизация почвенных коллоидов происходит при удалении избытка электролита (в случае обратимых гелей) и под действием ионов ОН–, увеличивающих заряд ацидоидов. При пептизации разрушается структура геля, коллоиды распыляются и приобретают способность к передвижению по почвенному профилю.
Особым явлением представляется процесс тиксотропии коллоидов – явление, при котором образующийся из золя гель не отделяется от дисперсионной среды, а застудневает вместе с ней и способен возвращаться в состояние золя при механическом воздействии. Явление тиксотропии широко распространено в почвах, распространенных в зоне многолетней мерзлоты.
Физическое состояние коллоидов в значительной степени зависит от состава поглощенных катионов. Чем больше валентность поглощенных катионов и больше их заряд, тем меньше электрокинетический потенциал частицы и легче идет процесс коагуляции. К.К. Гедройц расположил все катионы по их коагулирующей способности в следующий ряд: Li+ < Na+ < 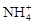 < K+ < Mg2+ < H+ < < Ca2+ < Ba2+ < Al3+ < Fe3+. Коллоиды, насыщенные одновалентными катионами, находятся, в основном, в состоянии золя; при замене одновалентных катионов двух- или трехвалентными они переходят в гель.
< K+ < Mg2+ < H+ < < Ca2+ < Ba2+ < Al3+ < Fe3+. Коллоиды, насыщенные одновалентными катионами, находятся, в основном, в состоянии золя; при замене одновалентных катионов двух- или трехвалентными они переходят в гель.
Реакция почвы также влияет на состояние коллоидов. Кислая реакция способствует растворению некоторых коллоидов, например, гидроксида алюминия; щелочная реакция стимулирует выпадение в осадок коллоидов полуторных оксидов и переход в состояние золя органических и некоторых минеральных коллоидов.
Электрокинетические свойства коллоидов обуславливают их способность к аккумуляции и передвижению в пределах почвенного профиля и к их участию в формировании аккумулятивных, элювиальных и иллювиальных горизонтов почв.
Огромное значение имеют также адсорбционные свойства коллоидов – способность поглощать катионы, анионы и целые молекулы находящихся в почвенном растворе веществ.
Состав почвенных коллоидов. Различают минеральные, органические и органоминеральные коллоиды.
Минеральные коллоиды представлены глинистыми минералами, коллоидными формами кремнезема и полуторных оксидов. Все глинистые минералы имеют кристаллическое строение, пластинчатую форму и являются типичными ацидоидами.
Характерные для глинистых частиц заряды обязаны своим происхождением замещению одних ионов на другие. Особенно большое значение имеет замещение Si4+ на Al3+ в тетраэдрах и Al3+ на Mg2+ в октаэдрах кристаллической решетки. Такие внутриструктурные замещения ионов в целом являются причиной появления зарядов на плоских поверхностях частиц глинистых минералов, в том числе и на плоских поверхностях частиц глинистых минералов с расширяющейся решеткой (монтмориллонита и вермикулита). В этих минералах около 80 % всей емкости приходится на внутреннюю поверхность, т.е. на поверхность элементарных пакетов. У каолинита внутренней поверхности нет, нет и внутренних замещений ионов. Его обменная емкость обусловлена свободными связями на боковых (торцевых) поверхностях пластинок. Здесь ионы обнажаются и часть присущих им связей оказывается свободной, ненасыщенной. Эти свободные связи и компенсируются обменными катионами.
Органические коллоиды представлены в почве, прежде всего, гумусовыми кислотами и их солями (гуматами, фульватами, алюмо- и железогумусовыми соединениями) и находятся, в основном, в состоянии гелей. Все они типичные ацидоиды. Являясь гидрофильными коллоидами, они легко меняют состояние: пептизируются при действии щелочных растворов и коагулируют под влиянием двух- и трехвалентных катионов. Характерная особенность гумусовых веществ – очень высокая емкость обменного поглощения катионов – обусловливает огромную их роль в поглотительной способности почв.
Органоминеральные коллоиды широко распространены в верхних горизонтах почв. Они представляют собой комплекс переменного состава из высокодисперсных минералов и гумусовых веществ, покрытых пленками гумусовых кислот, гуматов и фульватов алюмо- и железогумусовых солей. Основные минералы этих коллоидов – монтмориллонит и гидрослюды, а также всегда сопутствующие им в почве полуторные оксиды и кремнезем. эти коллоиды формируются в почве в процессе склеивания (адгезии) гумусовых кислот и их производных с поверхностью минеральной частицы. Органоминеральные коллоиды являются ацидоидами; относительно высокая емкость обменного поглощения катионов зависит от количества гумусовых веществ.
В любой почве основная масса коллоидов находится в форме гелей, различных по степени гидратации и прочности связи с поверхностью твердых частиц. Одна часть коллоидов находится в почве в свободном состоянии, другая образует пленки на поверхности более крупных гранулометрических фракций и сильно дегидратирована. Первая категория коллоидов легко пептизируется при щелочной реакции и насыщении их диффузного слоя натрием. Вторая очень прочно связана с поверхностью крупных гранулометрических фракций, и их пептизация затруднена.
Дата добавления: 2016-01-09; просмотров: 1008;