Функции белков плазмы
| Функция | Пример |
| Транспортная | Тироксинсвязывающий глобулин Транскортин Сексстероидсвязывающий белок Витамин Д-связывающий глобулин Гаптоглобин (транспорт гемоглобина) Гемопексин (транспорт гема) Аполипопротеины (транспорт холестерина, триацилглицеролов) Трансферрин (транспорт железа) Церулоплазмин (транспорт меди) |
| Гуморальный иммунитет | Иммуноглобулины |
| Поддержание онкотического давления | Все белки, особенно альбумины |
| Ферменты | Ренин, факторы свёртывания крови, белки комплемента |
| Ингибиторы протеаз | Альфа-1-антитрипсин |
| Буферность | Все белки |
ГЛАВА 2. БИОХИМИЯ ЭРИТРОЦИТОВ
СТРОЕНИЕ МЕМБРАН ЭРИТРОЦИТОВ. ОСОБЕННОСТИ
МЕТАБОЛИЗМА
Зрелые красные кровяные тельца обладают двояковогнутой формой и большой способностью к деформации, благодаря чему эффективно обеспечивают процессы диффузии газов и могут проходить через капилляры, диаметр которых в 3-4 раза меньше самих эритроцитов. Подобное свойство обусловлено особенностями в структуре мембран этих форменных элементов.
Принципы строения цитолеммы эритроцитов классические: основу составляет билипидный слой, в который встроены различные протеины. Наружная часть липидов представлена холинсодержащими соединениями (фосфатидилхолином, сфингомиелином), внутренняя поверхность обогащена фосфатидилсерином, фосфатидилэтаноламином, более четверти объёма приходится на холестерин. К цитозолю обращена плотная анастомозирующая белковая сеть, состоящая из спектринов, анкиринов, тропомиозинов, которые связываясь с интегральными гликопротеидами (гликофоринами) создают определённую жёсткость мембраны, определяют форму эритроцита (двояковогнутый диск). От степени фосфорилирования спектринов зависит эластичность сети, способность к упругой деформации. Гликофорины, пронизывая липидный слой, с помощью гидрофобных взаимодействий с фосфолипидами прочно фиксируются; их углеводные компоненты (олигосахариды, их производные, сиаловые кислоты), располагаясь на поверхности мембраны эритроцита, служат групповыми веществами крови: для О(Н) антигена детерминанта фукоза, для А-антигена - N-ацетилгалактоз-амин, для В – галактоза. Углеводные остатки гликофоринов являются также носителями антигенов групп крови MN-типа и ряда других иммунологических детерминант, служат рецепторами для вирусов гриппа и т.д.
Несмотря на отсутствие ядра и других органоидов, красные кровяные тельца весьма метаболически активные образования, обладающие спонтанной энергопродукцией на уровне 80 пДж на клетку. Энергетика эритроцита основана на анаэробном гликолизе (рис. 1). Глюкоза быстро проникает в клетку, независимо от присутствия инсулина.
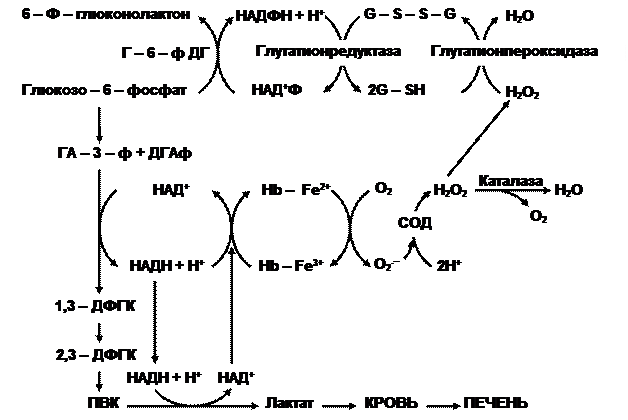
Рис.1. Схема гликолиза и антирадикальной защиты в эритроците.
В пути Эмбдена-Мейергофа глюкоза распадается до лактата с образованием АТФ путём субстратного фосфорилирования. Следует заметить, что кроме энергетической функции, метаболиты гликолиза используются в следующих процессах. Восстановительные потенциалы генерируются в виде НАДН, который при необходимости используется метгемоглобин-редуктазой для восстановления железа в метгемоглобине. В отличие от других тканей в эритроцитах в качестве метаболита образуется много 2,3-дифосфоглицерата (2,3-ДФГК) (в 1000 раз больше), который служит важным модулятором сродства гемоглобина к кислороду.
Некоторые морфобиохимические особенности красных кровяных телец предопределяют необходимость в высокой антиоксидантной активности. Во-первых, это высокие концентрации О2, что увеличивает вероятность образования его активных форм. Во-вторых, большое содержание ионов переходного металла – железа, что может способствовать его использованию в качестве донора электронов (рис.1). И, наконец, для обеспечения упругой деформации в липидном бислое мембран содержится больше ПНЖК – субстратов ПОЛ, чем в цитолемме других клеток. Для контроля интенсивности свободнорадикальных процессов, в цитоплазме эритроцитов активно работает антирадикальная защита.
Если нарушаются условия диссоциации оксигемоглобина (в кармане глобина, где расположен гем, оказываются ионы, молекулы воды), то в этом случае происходит отрыв электрона от двухвалентного железа гема с образованием метгемоглобина и супероксидного анион-радикала. Первое соединение восстанавливается с помощью метгемоглобинредуктазы, а радикал кислорода преобразуется под влиянием супероксиддисмутазы(СОД) в пероксид водорода, который также токсичен для клеток. Поэтому он восстанавливается с первоначально помощью каталазы, позднее глутатионпероксидазы (ГПО) (рис.1) и восстановленного глутатиона. Чтобы поддержать пул последнего, работает глутатионредуктаза (ГР), которая восстанавливает окисленную форму пептида, применяя в качестве восстановителя НАДФН. Необходимую концентрацию этого варианта кофермента получают путем окисления глюкозо-6-фосфата соответствующей дегидрогеназой. В мембранах эритроцитов продуктами свободнорадикальных процессов могут быть липопероксиды (ROOH), которые своевременно удаляются восстановленным глутатионом с участием ГПО:
| 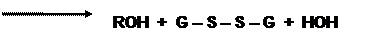 |
ОБМЕН ПОРФИРИНОВ
Порфирины широко распространены в природе. Они обнаружены в нефти, сланцах, глубинных минеральных водах, метеоритах, в образцах лунного грунта. Порфирины входят в состав хлорофилла растений, которые с его помощью улавливают солнечную энергию и осуществляют фотосинтез. В животном мире эти вещества участвуют в образовании гема, который служит простетической группой таких белков, как гемоглобин, миоглобин, каталаза, пероксидазы, цитохромы, триптофан-2,3-диоксигеназаи др.
Основой молекулярной структуры порфиринов является кольцо порфина, которое состоит из 4-х пирролов, соединённых друг с другом метиновыми мостиками (=СН – ). При восстановлении последних нарушается целостность сопряжённой системы, соединения становятся бесцветными, преобразуясь в порфириногены. Только они в организме подвергаются обменным превращениям. Порфирины же, лишенные дополнительных атомов водорода, метаболически инертны и выделяются из организма с мочой, желчью и калом.
Хотя способностью синтезировать порфирины обладает каждая клетка (кроме эритроцитов), их наибольшее количество образуется у человека в эритробластах костного мозга и гепатоцитах печени. В костном мозге порфирины, формируя комплексы с ионами железа (гем), утилизируются для образования гемоглобина. Синтезированные в печени порфирины включаются в цитохромы, в первую очередь, в Р450, а также в каталазы, пероксидазы и другие ферменты.
СИНТЕЗ ГЕМА
Исходными метаболитами синтеза гема, который катализирует сложная ферментативная система, служат сукцинил-КоА и глицин(по 8 молекул каждого) (Рис.2). Сукцинил-КоА является продуктом не только ЦТК, но и образуется при распаде треонина, метионина, тимина, высших жирных кислот с нечетным числом атомов углерода.
В ходе альдольной конденсации этих соединений (1) в митохондриях образуется 5-аминолевулиновая кислота(АЛК). Скорость этого процесса контролируется ключевым ферментом – 5-аминолевулинатсинтазой, кофактором которой является пиридоксаль-фосфат. Активность энзима индуцируется сниженным количеством гема.
|
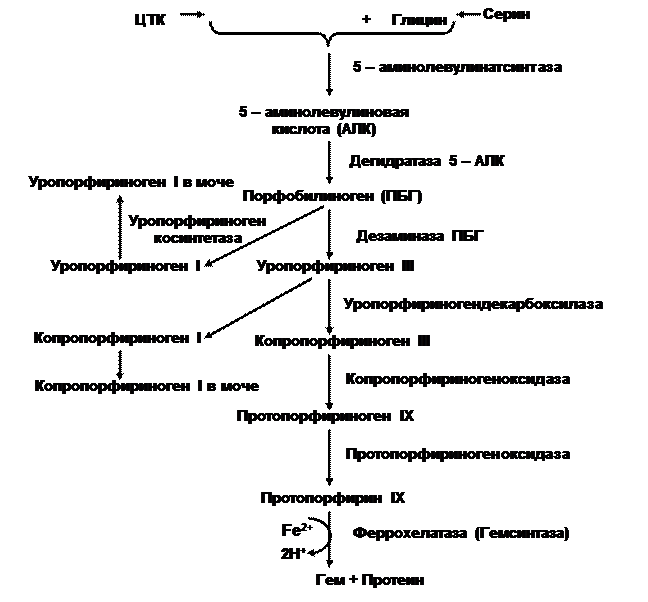
Рис.2. Система ферментов и основные этапы биосинтеза гема.
На втором этапе из молекул АЛК, вышедших в цитоплазму, под влиянием специфической дегидратазы (2) синтезируются 4 молекулы порфобилиногена (ПБГ). В дальнейшем из них формируется тетрапиррольная молекула уропорфириногена (УП-гена). Данный этап катализируется двумя энзимами: ПБГ–дезаминазой и уропорфириноген-косинтетазой (3). В этих условиях обычно образуется УП-ген III. При отсутствии косинтетазы или снижении её активности в значительных количествах получается изомер УП-ген I, который ограничен в своих дальнейших преобразованиях и, как побочный метаболит, выделяется из организма. В норме синтез изомеров 1 типа минимален, однако при некоторых патологических состояниях и генетических нарушениях эти вещества могут накапливаться (4).
Дальнейшие превращения УП-гена III, молекула которого содержит 8 карбоксильных групп, протекают под контролем УП-гендекарбоксилазы (4), осуществляющей последовательное декарбоксилирование соединения до копропорфириногена III (КП-ген). Затем, после возвращения в митохондрии, это соединение подвергается действию системы энзимов: КП-ген- и протопорфириноген-оксидаз (5,6). Под влиянием первого фермента происходит окислительное декарбоксилирование КП-гена III до протопорфириногена IХ (5), окисление которого катализируется вторым энзимом (6). В клетках костного мозга за сутки синтезируется до 30 мг этого соединения, которое комплексируясь с ионами двухвалентного железа (ферроионами), образует гем. Этот этап катализируется феррохелатазой (гемсинтетазой) (7). В дальнейшем, как отмечено выше, гем включается в различные белки – гемопротеиды.
Скорость синтеза гема регулируется следующими факторами:
а) активность АЛК-синтазы лимитирует этот процесс;
б) генез АЛК-синтазы определяется количеством железа;
в) уровень же последнего в клетке зависит от работы рецептора трансферрина.
Дата добавления: 2015-11-26; просмотров: 939;
