СТРОЕНИЕ ГЕМОГЛОБИНА
В разные периоды жизни зародыша и ребёнка активно работают различные гены, ответственные за синтез нескольких полипептидных цепей глобина. Выделяют 6 субъединиц: α, β, γ, δ, ε, ζ. Первая и последняя из них включают по 141, а остальные по 146 аминокислотных остатков. Друг от друга они отличаются не только количеством мономеров, но и их составом. Однако принцип образования вторичной структуры у всех цепей однотипен: они все сильно (до 75% длины) спирализованы за счёт водородных связей. Альфа-цепи включают 7, а бета, гамма, дельта – 8 спирализованных фрагментов, чередующихся с аморфными участками. Компактная укладка в пространстве подобного образования приводит к возникновению третичной структуры; причем при этом создаётся карман, куда и вкладывается гем. Возникший комплекс сохраняется с помощью приблизительно 60 гидрофобных взаимодействий между белком и простетической группой. Естественно, что в образовании углубления принимают активное участие гидрофобные аминокислоты (фенилаланин, валин, лейцин). Подобная глобула объединяется с 3 сходными субъединицами, используя для этого бисульфидные мостики и ковалентные взаимодействия (четвертичная структура). Получается белок, составленный из 4 полипептидных цепей (гетерогенный тетрамер), имеющий форму тетраэдра.
В зависимости от характера включённых протомеров различают следующие виды нормальных гемоглобинов (Hb). В первые 20 суток существования эмбриона в ретикулоцитах образуется Hb P (Primitive) в виде двух вариантов: Hb Gower 1, состоящего из дзета- и эпсилон-цепей, соединенных попарно, и Hb Gower 2, в котором дзета-последовательности уже заменены на альфа. Переключение генеза одного вида цепей на другой осуществляется медленно: вначале появляются отдельные клетки, продуцирующие иной вариант. Они дают стимул клонам новых клеток, синтезирующих другой вид полипептида. Позднее эти клетки начинают преобладать и постепенно вытесняют старые.
На 8-й неделе жизни зародыша включается синтез гемоглобина F = α2 γ2, по мере же приближения акта родов появляются ретикулоциты, содержащие Hb A = α2β2. На его долю у здорового взрослого человека приходится 96 – 98% от общей массы этого белка. Кроме того, в отдельных эритроцитах присутствуют гемоглобины Hb A2 = α2δ2 (1,5 – 3%) и фетальный (обычно не больше 1%). Однако в некоторых регионах, в том числе и у аборигенов Забайкалья концентрация последнего вида повышается до 4% (в норме).
ФОРМЫ ГЕМОГЛОБИНА
Описаны следующие формы данного гемопротеида.
а) Дезоксигемоглобин – свободная от газов форма протеина.
б) Оксигемоглобин – продукт включения кислорода в молекулу белка:
|
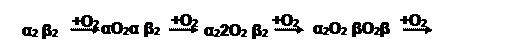
Интересно, что первоначальное связывание кислорода с одной субъединицей ускоряет присоединение последующих молекул (положительный кооперативный эффект). Одна молекула Hb способна удерживать 4 молекулы газа.
Структуры дезокси- и оксиHb несколько отличны. При отсутствии кислорода ферроион в гемоглобине имеет координационное число 5, связан c 4 атомами азота протопорфирина и с третичным атомом азота имидазольного кольца остатка гистидина белковой субъединицы. Шестое координационное место в оксигемоглобине способен занять только молекулярный кислород. Образованию этой связи благоприятствует высокая электронно-донорная способность порфириновой сопряженной системы и имидазола. Структура белка в Hb такова, что она экранирует подход к атому Fe (II) всех других молекул, имеющихся в крови, и своевременно регулирует его донорно-акцепторные свойства.
в) Исключение составляют токсиканты – яды крови, к которым относят и монооксид углерода. Проникая с атмосферным воздухом в лёгкие, СО быстро преодолевает альвеолярно-капиллярную мембрану, растворяется в плазме крови, диффундирует в эритроциты и вступает во взаимодействие с дезоки- и окси-Hb:
|

|
|
|
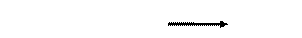
Образовавшийся карбоксигемоглобиннеспособен присоединять к себе кислород, а угарного газа может связывать 4 молекулы.
г) Важным производным Hb является метгемоглобин, в молекуле которого атом железа находится в степени окисления 3+ (в виде ферри-иона). Такая форма гемопротеида образуется при действии на него различных окислителей (оксидов азота, нитробензола, нитроглицерина, хлоратов, метиленового синего и др.), в результате в крови уменьшается количество функционально важного оксиHb, что нарушает доставку кислорода к тканям, вызывая в них развитие гипоксии.
д) Особенности строения концевых аминокислот в цепях глобина позволяют им реагировать с моносахаридами, в первую очередь, с глюкозой. В настоящее время выделяют несколько подвидов Hb A (от 0 до 1c), в которых к валину бета-цепей прикреплены олигосахариды. Особенно легко реагирует последний подвид гемопротеида. У образовавшегося при этом без участия фермента гликозилированного гемоглобина меняется его сродство к кислороду. Это объясняется тем, что присоединившаяся к белку глюкоза занимает место 2,3-ДФГК, что тормозит подкисление среды и тем самым противодействует диссоциации оксигемоглобина. В норме на долю подобной формы Hb приходится не более 5% от его общего количества. При сахарном диабете его концентрация возрастает в 2-3 раза, что благоприятствует возникновению тканевой гипоксии.
Дата добавления: 2015-11-26; просмотров: 1044;
