Индикаторы комплексонометрии
В комплексонометрическом титровании конечную точку
титрования устанавливают как визуально, так и с использованием инструментальных методов анализа. При визуальном установлении конечной точки титрования применяют металлоиндикаторы двух типов.
1. Органические соединения, не имеющие окраски, но образующие окрашенные комплексы с определяемым катионом. К таким соединениям относятся: салициловая кислота, сульфосалициловая кислота, тайрон, гидроксамовые кислоты. Эти индикаторы применяют редко. Интенсивность окраски их невысокая и поэтому требуется достаточно большая концентрация индикатора.
2. Ко второму многочисленному типу относятся индикаторы, которые содержат в своих молекулах хромофорные группы. Эти индикаторы называют металлохромными. Эти соединения образуют с металлами внутрикомплексные соединения, отличающиеся по цвету от самих индикаторов. Их разделяют обычно на три группы (см. таблицу):
1) Индикаторы, содержащие азогруппу
например, эриохромовый чёрный Т
или 1 (2-пиридилазо)-2-нафтол, арсеназо III и другие.
2)Индикаторы, относящиеся к классу трифенилметановых красителей, например, ксиленоловый оранжевый, пирокатехиновый фиолетовый, метилтимоловый синий.
3) Другие индикаторы разных типов органических соединений, например, мурексид, дитизон, ализарин и другие
Таблица 4 Значения логарифмов констант устойчивости lgβ комплексов катионов металлов состава 1:1 с некоторыми индикаторами в водных растворах при комнатной температуре
| Катион | Хромовый тёмно-синий | Эриохром чёрный Т | Ксиленоловый оранжевый | Мурексид | Кальконкарбо- новая кислота (кальцес) |
| Mg2+ | 8,5 | 7,0 | |||
| Ca2+ | 9,28 | 5,4 | 5,0 | 5,0 – 5,85 | |
| Sr2+ | 7,11 | ||||
| Ba2+ | 6,2 | 3,0 | |||
| Cu2+ | 17,9 | ||||
| Zn2+ | 10,5 | 12,9 | 6,1 | 3,1 | |
| Cd2+ | 3,2 | ||||
| Bi3+ | 5,5 | ||||
| Mn2+ | 9,6 | ||||
| Fe2+ | 5,7 | ||||
| Ni2+ | 4,8 | 11,3 |
Требования, предъявляемые к металлоиндикаторам
1. Металлоиндикаторы должны в выбранной области рН образовывать с ионами металлов достаточно устойчивые комплексы с соотношением компонентов 1:1.
2. Условные константы устойчивости комплексов катионов металлов с индикаторами должны быть меньше констант устойчивости металлов с ЭДТА
3. Комплекс иона металла с индикатором должен быть кинетически лабильным и быстро разрушаться при действии ЭДТА.
4. Изменение окраски раствора в конечной точке титрования должно быть контрастным.
Интервал перехода окраски индикатора
Образование комплекса определяемого катиона с индикатором происходит по схеме:
M+ Ind = MInd
Условная константа устойчивости комплекса равна
Из этого выражения следует, что
-lgM= pM , где рМ –показатель концентрации катионов М. Так как человеческий глаз ощущает переход цвета в интервале
тогда для границ интервала перехода окраски индикатора получаем
pM= lgβ ±1.
Наиболее резкий переход окраски наблюдается при pM= lgβ.
Кривые комплексонометрического титрования
Кривые комплексонометрического титрования – это графики зависимости концентрации определяемого катиона металла от объёма прибавляемого титранта. Кривые часто строят в координатах рМ от Vt, где Vt – объём прибавляемого титранта. Кривые можно также строить в координатах рМ от f , где f – степень оттитрованности раствора.
Рассмотрим построение кривой титрования на примере комплексонометрического титрования катионов цинка (II) стандартным раствором ЭДТА в сильно щёлочной среде. В этом случае вся незакомплексованная ЭДТА депротонирована (не содержит кислотных протонов) и находится в форме Y4 – .
При титровании протекает реакция образования комплекса ZnY2 – :
Константа устойчивости комплекса
β
До точки эквивалентности расчёт проводим по формуле
В процессе титрования катионы цинка связываются в прочный комплекс, и концентрация раствора уменьшается. Расчёт можно проводить по формуле
В точке эквивалентности все катионы цинка оттитрованы с образованием
Небольшое количество комплекса может диссоциировать по схеме:
Концентрация Zn в точке эквивалентности незначительна (практически все катионы цинка связаны в комплекс):
где С - концентрация определяемого катиона металла в определяемом растворе
Подставляя выражение (5) в (4) , мы получаем
выводим формулу (6) для расчёта концентрации Zn в точке эквивалентности.
Равновесную концентрацию катионов цинка после точки эквивалентности можно рассчитать из выражения для константы устойчивости комплексоната
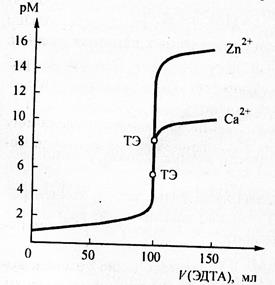
Рис. Рассчитанные кривые комплексонометрического титрования 100 мл растворов, содержащих катионы Zn2+ при концентрации 0,1 моль/л стандартным 0,1 моль/л раствором ЭДТА при рН =14.
На рис . представлена кривая комплексонометрического титрования катиона цинка раствором ЭДТА.
Значение рМ цинка в точке эквивалентности 8.6 . Скачок на кривой титрования равняется 14 – 4 =10. Полученная кривая титрования помогает выбрать соответствующий металлохромный индикатор. Интервал изменения окраски индикатора должен укладываться внутри скачка титрования, то есть рМ = lgβ
В таблице на странице приведены логарифмы констант устойчивости комплексных соединений металлов с некоторыми индикаторами. Для титрования цинка по данным таблицы подходит индикатор эриохром чё рный Т, у которого lgβ =12,9, что укладывается в скачок титрования.
Реальные кривые отличаются от рассчитанных, так как при расчёте мы допускаем определённые упрощения. Например, расчёт мы ведём для рН, при котором ЭДТА существует только в одной форме, а на самом деле имеют место и другие формы.
Влияние различных факторов на величину скачка
Чем больше величина скачка, тем точнее можно зафиксировать конечную точку титрования при визуальном индикаторном методе определения конечной точки титрования. Величина скачка зависит от ряда факторов:
1. От величин констант устойчивости комплексоната металла. Чем выше константа устойчивости β , тем больше величина скачка. Для малоустойчивых комплексонатов с lgβ<7 скачок на кривой титрования практически отсутствует и индикатор подобрать невозможно.
2. От концентрации титруемого катиона металла. Чем больше концентрация определяемого катиона, тем больше величина скачка. При концентрации металла менее 10–5 моль/л скачок на кривой титрования практически отсутствует и титрование проводить нецелесообразно.
3. От величины рН. Варьируя рН можно протитровать одни катионы в присутствии других катионов, что является ценным для аналитической практики.
Дата добавления: 2016-01-09; просмотров: 6201;
