Строение комплексных соединений
По числу σ–связей, образуемых лигандом с комплексообразователем различают монодентатные, бидентатные, тридентатные, ….
полидендатные лиганды.
Например,в комплексном катионе [Cu(NH3)4]2+ каждый лиганд NH3 монодентатный, а в комплексном катионе [Cu(NH2CH2CH2NH2)2]2+ каждый лиганд NH2CH2CH2NH2 бидентатный.
Координационные соединения, в которых центральный атом (или ион) связан одновременно с двумя или более донорными атомами лиганда, в результате чего замыкается один или несколько гетероциклов, называются хелатами. Лиганды, образующие хелатные циклы, называются хелатирующими (хелатообразующими) реагентами. Замыкание хелатного цикла такими лигандами называется хелатированием (хелатообразованием). Наиболее обширный и важный класс хелатов – хелатные комплексы металлов.
Например, катион бисэтилендиамин меди(II) комплекс представляет собой хелат.
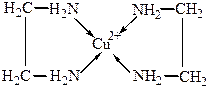
Природа химической связи в комплексных соединениях
Теория метода валентных связей объясняет образование комплексов за счёт донорно-акцепторной, или координационной, связи. Эта связь, как частный случай ковалентной связи, осуществляется между атомом-комплексообразователем, имеющим свободные орбитали и являющимся акцептором электронов, и лигандами, имеющими неподелённые электронные пары, донорами которых они являются. Донором может быть и комплексообразователь. Когда координационная связь образована, она практически ничем не отличается от обычной ковалентной связи. Например, в комплексном ионе [BF4]- донором электронной пары служит анион фтора, а акцептором — атом бора в молекуле BF3, обладающий незанятой орбиталью внешнего электронного слоя и переходящий при комплексообразовании в состояние sp3-гибридизации (конфигурация иона — тетраэдр).
Для объяснения строения простых и комплексных частиц с центральными атомами d-элементов, имеющими незавершённый внутренний (n-1)d–подуровень, используют метод ВС, дополненный теорией кристаллического поля.
Дата добавления: 2016-01-07; просмотров: 909;
