Теория поля лигандов
Теория поля лигандов объединяет метод молекулярных орбиталей и теорию кристаллического поля: электростатическое воздействие поля лигандов на несвязывающие орбитали центрального атома-комплексообразователя, которое связано со стереохимией, магнитными свойствами и оптическим поглощением комплексов, а связи металл-лиганд можно рассматривать с точки зрения локализованных молекулярных орбиталей, образующихся из соответствующих атомных орбиталей. Особое значение в теории поля лигандов имеет возможность p-донорного и p- дативного взаимодействия.
Теория молекулярных орбиталей даёт подход, учитывающий ковалентный характер связей. Основные принципы теории молекулярных орбиталей, развитых в своё время для двухатомных молекул, применимы и к координационным соединениям. Для комплекса волновая функция молекулярной орбитали yмо представляет собой линейную комбинацию, состоящую из волновых функций орбитали центрального атома металла jм и групповой орбитали лигандов åсjL(линейная комбинация определённых орбиталей лигандов):
yмо =аjм ± båсjL
Знак + в уравнении отвечает связывающей орбитали, знак – разрыхляющей.
Рассмотрим октаэдрические комплексы d-элементов. Система координат взаимного расположения комплексообразователя и лигандов октаэдрического комплекса ML6
показана на рис.31
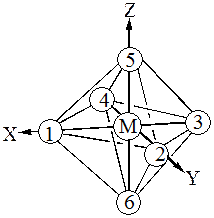
Рис.31 Схема октаэдрического комплекса ML6.
С учётом симметрии и энергетических соображений молекулярные орбитали(МО) строятся как линейная комбинация атомных орбиталей(АО). Могут образовываться как s -, так и p - молекулярные орбитали. Рассматривая связывание в октаэдрических комплексах, мы будем принимать во внимание в начале только s- взаимодействие. Металл (4 период) способен предоставить лигандам девять орбиталей: пять 3d, одну 4s и три 4р. Так, s-орбиталь комплексообразователя благодаря сферической симметрии одинаково перекрывается с орбиталями каждого из шести лигандов, расположенных по осям октаэдра. Это приводит к образованию семицентровых связывающей и разрыхляющей молекулярных ss – орбиталей(ss и s*s). Каждая из трёх р-орбиталей может перекрываться с орбиталями лигандов, расположенных по осям x,y,z:
px- орбиталь перекрывается только с орбиталями лигандов 1и 3, py- орбиталь – только с орбиталями лигандов 2и 4, pz- орбиталь – только с орбиталями лигандов 5 и 6. Это приводит к образованию семицентровых трёх связывающих и трёх разрыхляющих
sp -орбиталей(sx,sy,sz и sx*,sy*,sz*).Орбитали eg(sz2 и sx2-y2) перекрываются с орбиталями лигандов, соответствующим образом расположеннных в пространстве. При этом образуются две связывающие и две разрыхляющие молекулярные
s-орбитали (sz2, sx2-y2 и sz2*и sx2–y2*).Орбитали t2g (dxy,dyz,dxz ) не подходят для
s-связывания, так как они не направлены к орбиталям лиганда. Орбитали t2g могут перекрываться по p - типу с теми орбиталями лигандов, которые обладают подходящей для этого симметрией. Многие лиганды (например, NH3, H2O, Cl–, Br–) не имеют таких орбиталей с энергией, близкой к энергии t2g- орбиталей центрального атома. Между такими лигандами и центральным атомом не образуется p- связей. Электроны, находящиеся на орбиталях t2g в комплексах, где отсутствуют p- связи, мало отличающиеся от их энергии в несвязанном атоме металла. Считается, что электроны, занимающие в свободном атоме металла орбитали dxy,dyz,dxz , при образовании комплекса переходят на несвязывающие молекулярные орбитали t2g, которые по энергии и форме электронных облаков мало отличаются от атомных орбиталей (их обозначение pxyo, pyzo, pxzo).
Октаэдрические комплексы в основном состоянии имеют семь энергетических уровней, три из которых связывающие, три- разрыхляющие и один – несвязывающий.
Рассмотрим с помощью этого метода электронную конфигурацию низкоспинового иона [Co(NH3)6]3+. В образовании химической связи в этом комплексе участвуют 18 электронов: 6 электронов иона-комплексообразователя Co3+ и 12 электронов шести лигандов NH3 Молекулярные орбитали образуются в том случае, если атомные орбитали исходных взаимодействующих частиц близки по энергии и соответствующим образом ориентированы в пространстве. Орбиталь 4s иона Co3+ одинаково перекрывается с орбиталями каждого из шести лигандов, расположенных по осям октаэдра, в результате чего образуются семицентровые связывающая и разрыхляющая молекулярные орбитали:ss и ss*. Каждая из трёх 4р- орбиталей иона Co3+ перекрываются с орбиталями лигандов, так как последние расположены по осям р-орбиталей комплексообразователя. Это приводит к образованию шести семицентровых орбиталей:трёх связывающих sx , sy , sz и трёх разрыхляющих sx*, sy*,sz*. Орбитали sz2 и sx2-y2 иона Co3+ перекрываются с орбиталями лигандов, соответствующим образом расположенных в пространстве. При этом образуются четыре семицентровые молекулярные орбитали: две связывающие sz2,sx2-y2 и две разрыхляющие sz2 *, sx2-y2*. Орбитали dxy,dxz,dyz иона-комплексообразователя не направлены к орбиталям лигандов и не комбинируются с ними, поэтому не участвуют в образовании s-связи. Энергия этих орбиталей не изменяется, и они являются несвязывающими орбиталями. Их обозначение: pxzо,pxyо ,pyzо .
Таким образом, в комплексном ионе [Co(NH3)6]3+ пятнадцать молекулярных орбиталей: шесть связывающих, шесть разрыхляющих и три несвязывающих.
18 валентных электронов в низкоспиновом комплексном ионе [Co(NH3)6]3+ на молекулярных орбиталях располагаются следующим образом:(ss)2 , (sx)2, (sy)2 , (sz)2, (sx2-y2)2 , (sz)2 / (pxzо)2, (pxyо)2, (pyzо)2 .Схема образования молекулярных орбиталей в низкоспиновом комплексном ионе [Co(NH3)6]3+ представлена диаграммой на рис. 32.
Молекулярные орбитали pxyо ,pxzо, pyzо и s*x2-y2, s*z2 в теории поля лигандов соответствуют dx2-y2 , dz2 и dxy, dxz, dyz – орбиталям, возникающих при расщеплении
d - уровня в октаэдрическом поле лигандов. Таким образом, и в теории поля лигандов величина D соответствует энергии электронного перехода между уровнями t2g и eg . В соответствии с рассматриваемой теорией параметр расщепления D растёт с увеличением степени перекрывания исходных орбиталей, которое приводит к увеличению энергетического различия между связывающими и разрыхляющими орбиталями, т.е. значение D растёт с усилением s- связывания металл-лиганд.
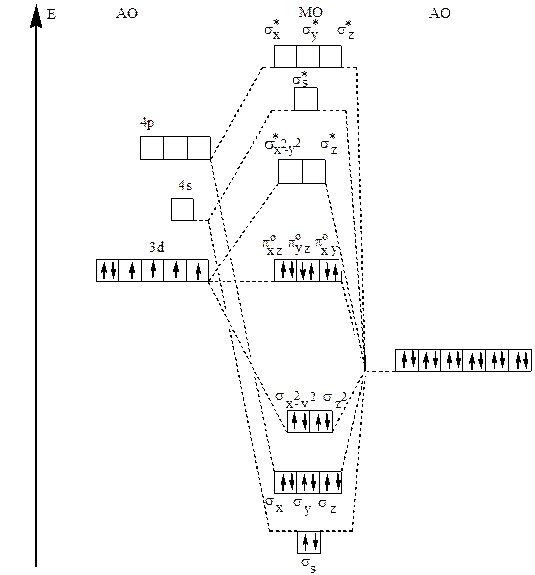
Рис.32 Схема распределения валентных электронов по молекулярным орбиталям октаэдрического низкоспинового комплексного иона [Co(NH3)6]3+.
Дата добавления: 2016-01-07; просмотров: 1382;
