Упражнения и задачи для самостоятельного решения. 1. Дайте определения понятиям «идеальный» и «реальный» растворы, «активность», «ионная сила», «коэффициент активности иона».
1. Дайте определения понятиям «идеальный» и «реальный» растворы, «активность», «ионная сила», «коэффициент активности иона».
2. Рассчитайте [Н3О +], [ОН –], а(Н3О+) , а(ОН–) и рН:
а) 0,01 М. раствора НС1,
б) раствора Н2SО4 с концентрацией С[0,5Н2SO4 ]= 0,01 моль/л;
в) 0,2 М раствора КОН;
г) раствора Ва(ОН)2. с концентрацией С[0,5 Ва(ОН)2]= 0,1моль/л.
Ответ:
а) [H3O+]=0,01моль/л; [OH–]=10-12моль/л;a(H3O+)=9,2∙10–3моль/л;
a(OH–)=1,1 ∙10–12моль/л; pH = 2,04.
б) [H3O+]=10–2моль/л; a(H3O+)=9,210–3моль/л; [OH–]=10–12моль/л;
a(OH–) = 1,1 ∙10–12 моль/л; pH = 2,04.
в) [OH–]=0,2моль/л; a(OH–)=0,136моль/л;
[Н3О+]=5∙10–14моль/л; a(H3O+)=7,4∙10-14моль/л; pH = 13,13.
г) [OH–]=0,1моль/л; a(OH–)=0,072моль/л; [H3O+]=10–13моль/л;
a(H3O+) =1,39∙10–13 моль/л; pH = 12,86.
3. Рассчитайте молярную концентрацию:
а) раствора HBr, если рН раствора равно 1,65.
б) раствора NaOH, если рН раствора равно11,26.
Ответ: а)c(HBr)= 0,022моль/л; б)c(NaOH)=0,0018 моль/л
4. Вычислите с учётом коэффициентов активности ионов рН водного
раствора, содержащего гидроксид натрия [w(NaOH)= 0,05%] и хлорид натрия [w(NaCl)= 0,2%], если плотность раствора равна 1,02г/мл.
Ответ: рН=12,03.
5. Рассчитайте рН раствора, содержащего в 2,5л одновременно
0,0032 моль HNO3 и 0,0083 моль H2SO4. Ответ: рН = 2,14.
6. Вычислите рН конечного водного раствора, полученного при смешении 20 мл 0,1 М НС1 и 20 мл О,2М KOH с последующим разбавлением водой до объёма 1л.
Ответ: рН = 11,3.
БУФЕРНЫЕ РАСТВОРЫ
Основные понятия
В самом широком смысле буферными называются системы, поддерживающие определённое значение какого-либо параметра при изменении состава. Буферные растворы могут быть кислотно-основными — поддерживающими постоянное значение рН при введении кислот или оснований; окислительно-восстановительными, сохраняющими постоянным потенциал систем при введении окислителей или восстановителей и др.
Кислотно-основной буферный раствор представляет собой сопряжённую кислотно-основную пару.
Основные типы буферных водных растворов:
1. Слабая кислота и её анион.
2. Слабое основание и его катион.
3. Анионы средней и кислой соли; анионы двух кисдлых солей.
4. Ионы и молекулы амфолитов ( аминокислотные и белковые системы).
Например, ацетатный буферный раствор состоит из СН3СООН и сопряжённого с ней основания СН3СОО–, гидрокарбонатный —из НСО3-и СО2∙Н2О ,аммонийный — из аммиака NH3 и сопряжённой с ним кислоты NH4+ ,фосфатный— из кислоты H2PO4– и сопряжённой с ней HPO42–. В растворе, содержащем сопряжённую пару, устанавливаются равновесия.
Например, для ацетатного буфера:
СН3СООН + Н2О = Н3О+ + СН3СОО– (1)
СН3СОО– + Н2О = СН3СООН + ОН– (2)
Оба равновесия сильно сдвинуты влево, поскольку в растворе находятся достаточные количества как кислоты CH3COOH, так и основания CH3COO–. Константа равновесия (1) является константой кислотности CH3COOH:
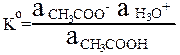
рН буферного раствора рассчитывается по уравнению Гендерсона—Хассельбаха:
рН = рКа + lg а(буф.осн.) / а(буф.к-та)
Так, для ацетатного буферного раствора уравнение имеет вид:
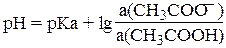
рКа — константа кислотности уксусной кислоты, а(CH3COO–) —активность буферного основания , а(CH3COOH)— активность буферной кислоты
Для аммиачного буфера:
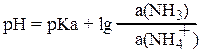
рКа — константа кислотности буферной кислоты NH4+, a(NH3) — активность буферного основания, a(NH4+) — активность буферной кислоты.
При малой ионной силе вместо активностей можно использовать концентрации:
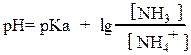
Для гидрокарбонатного буфера:
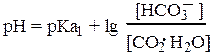
Буферные системы на основе глицина. Если раствор аминокислоты находится в иоэлектрическом состоянии (суммарный заряд молекулы равен нулю), он не является буферным. Буферное действие появляется, когда к раствору добавляют некоторое количество кислоты или щёлочи. Устанавливаются следующие равновесия:
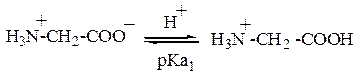
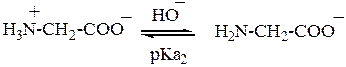
Уравнение Гендерсона—Хассельбаха для первого равновесия:
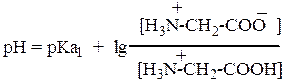
Для второго равновесия:
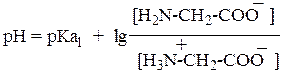
где pKa1 = 2,43 и pKa2 = 9,63
При изучении метаболических процессов in vitro приходится использовать «нефизиологические» буферные растворы для направленного изменения рН, что позволяет значительно облегчить изучение таких типов молекул, как аминокислоты, белки и нуклеиновые кислоты с помощью электрофореза и иннообменной хроматографии.
Основные требования к буферным системам, применяемым для биологических исследований:
–обладать высокой степенью чистоты.
–обладать достаточной буферной ёмкостью в требуемом диапазоне рН.
–хорошо растворятьсяч в воде и не проникать через биологические мембраны.
–рН буферных растворов должна иметь минимальную зависимость от концентрации теп\мпературы и ионного состава среды.
–комплексы буфера с катионами должны быть растворимыми.
–буферы должны быть устойчивы к действию ферментов не оказывать токситческого или ингибирующего действия.
Поддержание стабильного рН культуральных сред обеспечивается чаще всего тремя возможными буферными системами: гидрокарбонатным , фосфатным , HEPES. В последнее время для биологических исследований широко используется буферный агент HEPES (— 4–(2–hydroxyethyl)–1–piperazineethanesulfonic acid ) Среды на основе HEPES способны к поддержанию рН на уровне 7,3–7,5 в условиях атмосферного газового состава при 37оС для биологических исследований вне инкубатора.
Дата добавления: 2016-01-07; просмотров: 721;
