Распознавание галогенидов
Катион серебра в присутствии разбавленной азотной кислоты осаждает из растворов анионы Сl-, Br-, I- по уравнениям реакции: Ag++Cl-=AgCl¯ Ag++Br-= AgBr¯ Ag++I-=AgI¯
Таким образом, эти реакции являются качественными. AgCl — белый творожистый осадок, нерастворимый в воде и азотной кислоте, но растворимый в аммиаке. AgCl+2NH4OH=[Ag(NH3)2]Cl+2Н2O
При подкислении раствора комплекс разрушается, и AgCl снова выпадает в осадок:
[Ag(NH3)2]Cl+2HCl=AgCl¯+2NH4Cl
AgBr — осадок бледно-желтого цвета, нерастворим в воде и азотной кислоте. Быстро темнеет.
AgI — осадок ярко-желтого цвета.
Из наиболее важных галогенидов можно привести следующие:
Хлорид натрия (каменная соль, поваренная соль, галлит) NaCl — является важнейшей приправой к пище, служит сырьем для получения гидроксида натрия, хлора, соляной кислоты, соды и др., используется для консервирования продуктов питания.
Хлорид калия КС1 — ценное калийное удобрение.
Хлорид цинка ZnCl2 — используют для пропитки древесины в целях предохранения от гниения; применяют также при паянии для смачивания поверхности металла (устраняет пленку оксида, и припой хорошо пристает к металлу). Известны кристаллогидраты ZnCl2•nH2О.
Хлорид бария ВаСl2 — ядовитое вещество, используется для борьбы с вредителями сельского хозяйства.
Хлорид кальция СаСl2 (безводный) — широко применяют для осушения газов (образуется кристаллогидрат СаСl2•6Н2О) и в медицине.
Хлорид алюминия АlСl3 (безводный) — часто используется как катализатор при органическом синтезе.
Хлорид ртути (II), или сулема, HgCl2 — сильный яд; очень разбавленные растворы соли применяют как сильнодействующее дезинфицирующее средство, используют также для протравливания семян, дубления кожи; в органическом синтезе.
Хлорид серебра AgCl — используется в фотографии.
Бромид серебра AgBr — в фото- и кинопромышленности. Бромиды в медицине используются для успокоения нервной системы.
Иодид серебра AgI — используется как светочувствительный материал.
Раствор иода в водном растворе иодида калия KI+I2— является раствором люголя и используется в медицине.
Кислородсодержащие соединения галогенов
Все кислородные соединения галогенов получены косвенным путем. Наиболее устойчивы соли, наименее — оксиды и кислоты.
Для галогенов характерно образование большого числа оксидов, отвечающих различным степеням окисления. Больше всего
Таблица 17. Оксиды галогенов и соответствующие кислоты
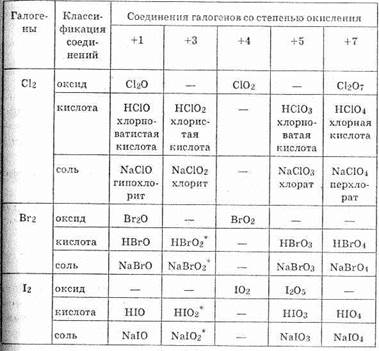
— ионы BrO-2 и IO-2 очень неустойчивы.
устойчивых оксидов образует хлор Сl, меньше всего — иод I (см. табл.17). Из соединений кислорода с фтором существует фторид кислорода F-12О+2:
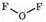
Связь между атомами фтора и кислорода ковалентная, очень близка к неполярной. Это бесцветный газ с резким запахом озона, плохо растворим в воде, tкипения=-145°С. Был открыт в 1929 году. получается взаимодействием фтора с 2% -ным раствором гидроксида натрия:
2F2+2NaOH=2NaF+Н2О+F2O
I Рассмотрим важнейшие из кислородных соединений остальных галогенов.
Все оксиды неустойчивы, разлагаются с большим выделением тепла.
Оксид хлора (I) Сl2О — газ буро-желтого цвета с неприятным запахом. Характеризуется низкой температурой кипения, относительная плотность по воздуху равна 3.
Связь в молекуле оксида малополярная ковалентная.
Электронная структура:
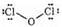
Обладает следующими химическими свойствами:
1. При нагревании легко распадается (со взрывом) на хлор и кислород:
2С12O=t2Сl2+О2
2. Будучи кислотным оксидом, гидратируется с образованием хлорноватистой кислоты:
Сl2O+Н2O=2НСlO
3. Взаимодействует с щелочами и основными оксидами:
Сl2O+2NaOH=2NaClO+Н2O
Сl2O+K2O=2KСlO
Оксиду хлора (I) соответствует хлорноватистая кислота.
Хлорноватистая кислота НСlO и ее бромный и йодный аналоги — очень слабые кислоты, причем их сила уменьшается при переходе от НСlO к НIO. Это объясняется тем, что хлор обладает большей электроотрицательностью и сильнее своих аналогов притягивает электронную пару, связывающую его с кислородом. Это в свою очередь приводит к смещению электронной пары, связывающей водород с кислородом, к кислороду и увеличению способности водорода к отщеплению.
Хлорноватистая кислота представляет собой раствор желто-зеленого цвета с характерным запахом. Она и ее аналоги обладают всеми свойствами слабых летучих кислот, являются кислотами-окислителями. Причем окислительная активность в ряду НСlO, НBrO, НIO снижается.
1. На свету хлорноватистая кислота разлагается:
НСl+1O-2 =hv НСl-1+О0
2. При действии водоотнимающих средств распадается:
2НСl+1O=Сl+12O+Н2О
3. При нагревании хлорноватистой кислоты образуется соляная и хлорноватая кислоты:
3НСl+1О=2НСl-1+НСl+5O3 окислитель Сl++2е- ®Сl-восстановитель Сl+-4е- ®Сl+5
Наибольшее значение имеют соли кислородных кислот хлора. Все их можно получить, исходя из реакции взаимодействия хлора с водой (см. §2.1).
Сl2+Н2О«НСl+НСlO
Равновесие этой реакции легко сместить в сторону продуктов реакции, добавив в раствор щелочи, которая реагирует с двумя образующимися кислотами:
НСl+НСlO+2КОН=КСl+КСlO+2Н2O I Просуммировав эти два уравнения, получим:
Сl2+2КОН=КСl+КСlO+Н2O
Сl2+2OH-=Сl-+СlO-+Н2О
Соли хлорноватистой кислоты называют гипохлоритами. Водный раствор, содержащий гипохлорит и хлорид калия, называют жавелевой водой. Она, как и хлорная (раствор хлора в воде) вода, употребляется для беления хлопчатобумажной ткани и бумаги.
Механизм окисляющего и дезинфицирующего действия хлорноватистой кислоты и ее солей объясняют наличием хлора со степенью окисления +1, проявляющего в этих процессах активные окислительные свойства.
Сl++1e-®Сl° Сl++2e-®Сl-
Гипохлориты — очень сильные окислители. При пропускании хлора в раствор щелочи, нагретый до 100°С, процесс протекает с образованием хлоратов (солей хлорноватой кислоты НСlO3) и хлоридов:
ЗСl2+6КОН=5КСl+КСlO3+3Н2O ЗСl2+6OH-=5Сl-+СlO-3+3Н2О
При нагревании до 400°С в отсутствие катализаторов из хлоратов образуются перхлораты (соли хлорной кислоты НСlO4): 4КСlO3=3КСlO4+КСl
В присутствии катализатора (MnO2) процесс протекает по уравнению:
2КСlO3=2КСl+3O2
Таким образом, соли кислородных кислот хлора получают взаимодействием хлора с щелочью. При этом при комнатной температуре образуются гипохлориты, при 100°С — хлораты. Это окислительно-восстановительные реакции.
Хлористая кислота НСlО2 — средней силы. Она малоустойчива в водных растворах, а ее аналоги брома и иода еще менее
прочны.
Сила кислородных кислот хлора возрастает с ростом степени
окисления центрального атома: НСl+1O — слабая; НСl+3O2 — несколько более сильная; НСl+5O3 — очень сильная и НСlO+74 — самая сильная из всех известных кислот.
Если хлор взаимодействует с гидроксидом кальция, который берется в виде порошка — пушонки, то образуется хлорная, или белильная, известь — рыхлый белый порошок с запахом хлора. Она состоит главным образом из гипохлорита кальция Са(СlO)2, основных солей кальция и хлорида кальция.
Примерное уравнение:
2Сl2+2Са(ОН)2=Са(СlO)2+СаСl2+2Н2О
Часто для повышения качества хлорной извести к ней добавляют Са(СlO)2.
Хлорная известь — сильный окислитель. Она очень реакционноспособна. Применяется для беления хлопчатобумажных тканей, бумаги, для хлорирования воды, дезинфекции, а также для дегазации местности, зараженной стойкими отравляющими
веществами.
Белящие и дезинфицирующие свойства хлорной извести аналогичны свойствам жавелевой и хлорной воды: угольная кислота вытесняет из гипохлорита кальция хлорноватистую кислоту; на свету она разлагается с выделением атомарного кислорода, который и оказывает окисляющее действие.
Дата добавления: 2016-01-03; просмотров: 3132;
