Физические свойства галогенов
Галогены. Галогеноводороды. Галогениды. Кислородсодержащие соединения галогенов
Галогены

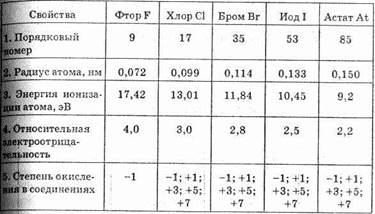
В подгруппу галогенов входят фтор, хлор, бром, иод и астат. Первые четыре элемента встречаются в природе в виде различных соединений. Астат получен только искусственным путем, радиоактивен. Это р-элементы VII группы периодической системы Д . И. Менделеева. На внешнем энергетическом уровне их атомы имеют по 7 электронов ns2np5 (см. табл. 14).
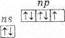
Этим объясняется общность их свойств.
Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с водородом и металлами.
Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления: +1, +3, +5, +7. Возможные значения степеней окисления объясняются электронным строением атомов, которое у атома фтора можно представить схемой:
Таблица 14. Свойства элементов подгруппы галогенов

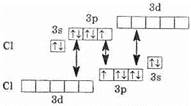
Будучи наиболее электроотрицательным элементом, фтор может только принимать один электрон на 2р-уровень. У него один неспаренный электрон, поэтому фтор бывает только одновалентным, а его степень окисления всегда -1. Электронное строение атома хлора выражается схемой:
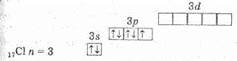
У атома хлора один неспаренный электрон на 3р-подуровне, и в обычном (невозбужденном) состоянии хлор одновалентен. Но поскольку хлор находится в третьем периоде, то у него имеются еще пять орбиталей 3d-подуровня, в которых могут разместиться 10 электронов.
В возбужденном состоянии атома электроны хлора переходят с3p- и3s-подуровней на 3d-подуровень (на схеме показано стрелками). Разъединение (распаривание) электронов, находящихся на одной орбитали, увеличивает валентность на две единицы. Очевидно, что хлор и его аналоги (кроме фтора) могут проявлять лишь нечетную переменную валентность 1,3,5,7 и соответствующие положительные степени окисления. У фтора нет свободных
орбиталей, а значит, при химических реакциях не происходит разъединения спаренных электронов в атоме. Поэтому при рассмотрении свойств галогенов всегда надо учитывать особенности фтора.
В пределах каждого периода галогены являются наиболее электроотрицательными элементами, обладающими наибольшим сродством к электрону.
Внутри подгруппы галогенов переход от фтора к иоду сопровождается увеличением радиуса атома.
Элементы Подгруппы относятся к неметаллам; с увеличением заряда ядра от F к At неметаллические признаки ослабевают, o чем свидетельствуют уменьшение потенциалов ионизации и сродство к электрону.
Окислительно-восстановительные свойства и различия в химическом поведении галогенов легко понять, сравнивая эти свойства в зависимости от изменения заряда ядра при переходе от F к I. В ряду F, Cl, Br, I наибольшим радиусом атома (и, следовательно, наименьшим сродством к электрону) обладает I, поэтому он характеризуется менее выраженными окислительными свойствами, чем Br, Cl, F. Следовательно, окислительные свойства нейтральных атомов в подгруппе галогенов уменьшаются от F к I, а восстановительные усиливаются:

Связь Гал-Гал в молекулах простых веществ ковалентная неполярная. Длина связи в молекуле от F2 к I2 закономерно увеличивается. Энергия же связи изменяется следующим образом.
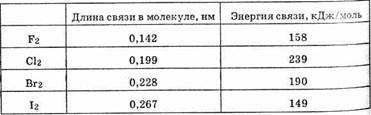
Энергия связи в молекуле F2 менее прочная, чем в молекуле Сl2. Это объясняется образованием в молекуле Сl2 и соответственно Br2 и I2 даттивной связи: когда общее энергетическое облако образуется за счет не только спаривания р-электронов, но и за счет уже имеющихся спаренных р-электронов одного атома и вакантной d-орбитали другого атома.
Распространенность в природе
Распространенность фтора и хлора близка друг к другу и довольно велика (6,5 • 10-2% по массе и 4,5•10-2% соответственно); распространенность брома и иода гораздо меньше — 1,6•10-4 и 4 • 10-5%. Фтор играет определенную биологическую роль — от содержания его в воде зависит, в частности, состояние зубов, т.к. фторид кальция входит в состав зубной ткани.
Концентрация хлора (Сl-) в тканях организма относительно велика, и функции его разнообразны — они связаны с активацией ферментов, передачей нервного возбуждения и др. Функции брома изучены плохо, а иод, несомненно, играет очень важную роль, так как входит в состав гормона щитовидной железы — тироксина, определяющего общий темп окислительных процессов в организме.
I В природе в свободном состоянии хлор встречается в вулканических газах. Широко распространены его соединения: хлорид натрия NaCl, хлорид калия КСl, хлорид магния MgCl2•6H2O, сильвинит, состоящий из NaCl и КСl, карналлит состава КС1•MgCl2•6Н2О, каинит состава MgSO4•КСl•3Н2О и др.
Получение галогенов
1. Важнейший способ получения фтора — электролиз расплавов фторидов, где фтор выделяется на аноде:
2F--2e-®F2
В качестве основного источника получения используется гидрофторид KHF2.
2. Хлор в лабораторных условиях получают из соляной кислоты при взаимодействии ее с оксидом марганца (IV). Реакция прорекает при нагревании.
4HСl-1+Mn+4O2=Сl02+Mn+2Сl2+2Н2O
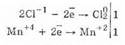
Вместо окислителя MnO2 можно применить перманганат калия KMnO4. Тогда реакция протекает при обычной температуре,
16НСl-1+2KMn+7O4=5Сl02+2Mn+2Сl2+2КСl+8Н2О
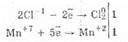
В промышленности хлор получают электролизом раствора хлорида натрия. Газообразный хлор выделяется на аноде:
2NaCl+2Н2O электролиз®2NaOH+H2+Cl2
3. Для получения брома чаще применяют реакцию замещения его в бромидах. 2KBr+Сl2=2KСl+Br2
4. Основные источники получения иода — это морские водоросли и нефтяные буровые воды.
2NaI+MnO2+3H2SO4=I2+2NaHSO4+MnSO4+2Н2О Получение иода из его природных источников сводится к переводу его в молекулярный:
2NaI+2NaNO2+2H2SO4=I2+2H2O+2NO+2Na2SO4
5. В лабораторных условиях бром и иод получают одним и тем же способом: действием оксида марганца (IV) на бромиды или иодиды в кислой среде, например:
MnO2+2KBr+2H2SO4=MnSO4+Br2+K2SO4+2Н2О
Физические свойства галогенов
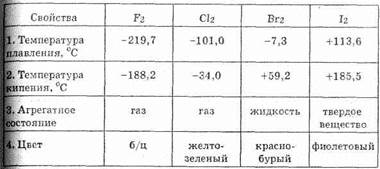
С увеличением заряда ядра от фтора к иоду возрастают температура плавления, кипения (см. табл. 15), электрическая проводимость. Галогены обладают резким запахом и ядовиты. Плохо растворяются в полярных растворителях, хорошо в органических растворителях (спирт, бензол).
Хлор — ядовитый газ желто-зеленого цвета с резким запахом. Тяжелее воздуха в 2,5 раза. Хлор вызывает раздражение дыхательных путей, а вдыхание большого его количества вызывает смерть от удушья. В природном хлоре содержится два изотопа — 3517Сl (75,53%) и 3717Сl (24,47%).
Фтор ядовит чрезвычайно. Бром — тяжелая красно-бурая жидкость. Пары брома ядовиты. При попадании на кожу вызывает сильные ожоги. Иод — черно-фиолетовое твердое вещество При нагревании образуются фиолетовые пары, которые при охлаждении снова превращаются в кристаллы. Происходит возгонка иода, т.е. испарение твердого вещества и образование кристаллов из паров, минуя жидкое состояние.
Таблица 15. Свойства простых веществ подгруппы галогенов
Дата добавления: 2016-01-03; просмотров: 2955;
