Химические свойства галогенов
Фтор может быть только окислителем, что легко объяснить его положением в периодической системе химических элементов Д. И. Менделеева. Это сильнейший окислитель, окисляющий даже некоторые благородные газы:
2F2+Хе=XeF4
Высокую химическую активность фтора следует объяснить
о на разрушение молекулы фтора требуется намного меньше энергии, чем ее выделяется при образовании новых связей.
Так, вследствие малого радиуса атома фтора неподеленные электронные пары в молекуле фтора взаимно сталкиваются и ослабевает
связь F—F.
Галогены взаимодействуют почти со всеми простыми веществами.
1. Наиболее энергично протекает реакция с металлами. При нагревании фтор взаимодействует со всеми металлами (в том числе с золотом и платиной); на холоду реагирует с щелочными металлами, свинцом, железом. С медью, никелем реакция на холоду не протекает, поскольку на поверхности металла образуется защитный слой фторида, предохраняющий металл от дальнейшего окисления.
Хлор энергично реагирует с щелочными металлами, а с медью, железом и оловом реакция протекает при нагревании. Аналогично ведут себя бром и иод.
Взаимодействие галогенов с металлами является экзотермическим процессом и может быть выражена уравнением:
2М+nHaI2=2МНаI DH<0
Галогениды металлов являются типичными солями.
Галогены в этой реакции проявляют сильные окислительные свойства. При этом атомы металла отдают электроны, а атомы галогена принимают, например:
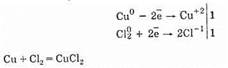
2. При обычных условиях фтор реагирует с водородом в темноте со взрывом. Взаимодействие хлора с водородом протекает на ярком солнечном свету.
Бром и водород взаимодействуют только при нагревании, а иод с водородом реагирует при сильном нагревании (до 350°С), но этот процесс обратимый.
H2+F2=2HF
Н2+Сl2=2НСl Н2+Br2=2НBr
Н2+I2 «350°2HI
Галоген в данной реакции является окислителем.
Как показали исследования, реакция взаимодействия водорода с хлором на свету имеет следующий механизм.
Молекула Сl2 поглощает квант света hv и распадается на неорганические радикалы Сl.. Это служит началом реакции (первоначальное возбуждение реакции). Затем она продолжается сама собой. Радикал хлора Сl. реагирует с молекулой водорода. При этом образуется радикал водорода Н. и НСl. В свою очередь радикал водорода Н. реагирует с молекулой Сl2, образуя НСl и Сl. и т.д.
Сl2 +hv=Сl. +Сl.
Сl. +Н2=НСl+Н.
Н.+Сl2=НСl+С1.
и т.д.
Первоначальное возбуждение вызвало цепь последовательных реакций. Такие реакции называются цепными. В итоге получается хлороводород.
3. Галогены с кислородом и азотом непосредственно не взаимодействуют.
4. Хорошо реагируют галогены с другими неметаллами, например:
2Р+3Сl2=2РСl3 2Р+5Сl2=2РСl5 Si+2F2=SiF4
Галогены (кроме фтора) не реагируют с инертными газами. Химическая активность брома и иода по отношению к неметаллам выражена слабее, чем у фтора и хлора.
Во всех приведенных реакциях галогены проявляют окислительные свойства.
Взаимодействие галогенов со сложными веществами. 5. С водой.
Фтор реагирует с водой со взрывом с образованием атомарного кислорода:
H2O+F2=2HF+O
Остальные галогены реагируют с водой по следующей схеме:
Гал02+Н2О«НГал-1+НГал+1О
Эта реакция является реакцией диспропорционирования, когда галоген является одновременно и восстановителем, и окислителем, например:
Сl2+Н2O«НСl+НСlO
Cl2+H2O«H++Cl-+HClO
Сl°+1e-®Сl-Cl°-1e-®Сl+
где НСl — сильная соляная кислоты; НСlO — слабая хлорноватистая кислота
6. Галогены способны отнимать водород от других веществ, скипидар+С12 = НС1+углерод
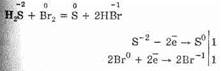
Хлор замещает водород в предельных углеводородах: СН4+Сl2=СН3Сl+НСl
и присоединяется к непредельным соединениям:
С2Н4+Сl2=С2Н4Сl2
7. Реакционная способность галогенов снижается в ряду F—Сl — Br — I. Поэтому предыдущий элемент вытесняет последующий из кислот типа НГ (Г — галоген) и их солей. В этом случае активность убывает: F2>Сl2>Br2>I2

Применение
Хлор применяют для обеззараживания питьевой воды, отбелки тканей и бумажной массы. Большие количества его расходуются для получения соляной кислоты, хлорной извести и др. Фтор нашел широкое применение в синтезе полимерных материалов — фторопластов, обладающих высокой химической стойкостью, а также в качестве окислителя ракетного топлива. Некоторые соединения фтора используют в медицине. Бром и иод — сильные окислители, используются при различных синтезах и анализах веществ.
Большие количества брома и иода расходуются на изготовление лекарств.
Галогеноводороды
Соединения галогенов с водородом НХ, где X — любой галоген, называются галогеноводородами. Вследствие высокой электроотрицательности галогенов связующая электронная пара смещена в их сторону, поэтому молекулы этих соединений полярны.
Галогеноводороды — бесцветные газы, с резким запахом, легко растворимы в воде. При 0°С в 1 объеме воды растворяете 500 объемов НС1, 600 объемов HBr и 450 объемов HI. Фтороводород смешивается с водой в любых соотношениях. Высокая растворимость этих соединений в воде позволяет получать концентриро-
Таблица 16. Степени диссоциации галогеноводородных кислот
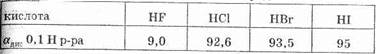
ванные растворы. При растворении в воде галогеноводороды диссоциируют по типу кислот. HF относится к слабо диссоциированным соединениям, что объясняется особой прочностью связи в куле. Остальные же растворы галогеноводородов относятся к числу сильных кислот.
. HF — фтороводородная (плавиковая) кислота НС1 — хлороводородная (соляная) кислота HBr — бромоводородная кислота HI — иодоводородная кислота
Сила кислот в ряду HF — НСl — HBr — HI возрастает, что объясняется уменьшением в том же направлении энергии связи и увеличением межъядерного расстояния. HI — самая сильная кислота из ряда галогеноводородных кислот (см. табл. 16).

Поляризуемость растет вследствие того, что вода поляризует
больше ту связь, чья длина больше. I Соли галогеноводородных кислот носят соответственно следующие названия: фториды, хлориды, бромиды, иодиды.
Химические свойства галогеноводородных кислот
В сухом виде галогеноводороды не действуют на большинство металлов.
1. Водные растворы галогеноводородов обладают свойствами бескислородных кислот. Энергично взаимодействуют со многими металлами, их оксидами и гидроксидами; на металлы, стоящие в электрохимическом ряду напряжений металлов после водорода, не действуют. Взаимодействуют с некоторыми солями и газами.
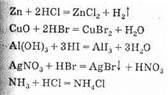
Фтороводородная кислота разрушает стекло и силикаты:
SiO2+4HF=SiF4+2Н2O
Поэтому она не может храниться в стеклянной посуде.
2. В окислительно-восстановительных реакциях галогеноводородные кислоты ведут себя как восстановители, причем восстановительная активность в ряду Сl-, Br-, I- повышается.
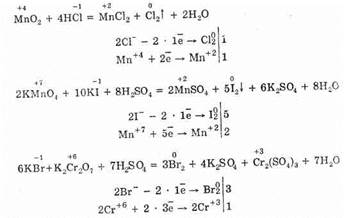
Получение
Фтороводород получают действием концентрированной серной кислоты на плавиковый шпат:
CaF2+H2SO4=CaSO4+2HF
Хлороводород получают непосредственным взаимодействием водорода с хлором:
Н2+Сl2=2НСl
Это синтетический способ получения.
Сульфатный способ основан на реакции концентрированной
серной кислоты с NaCl.
При небольшом нагревании реакция протекает с образованием НСl и NaHSO4.
NaCl+H2SO4=NaHSO4+HCl
При более высокой температуре протекает вторая стадия реакции:
NaCl+NaHSO4=Na2SO4+HCl
Но аналогичным способом нельзя получить HBr и HI, т.к. их соединения с металлами при взаимодействии с концентрировав-
ной серной кислотой окисляются, т.к. I- и Br- являются сильными восстановителями.
2NaBr-1+2H2S+6O4(к)=Br02+S+4O2+Na2SO4+2Н2O
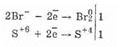
Бромоводород и иодоводород получают гидролизом PBr3 и PI3: PBr3+3Н2O=3HBr+Н3PO3 PI3+3Н2О=3HI+Н3РO3
Галогениды
Галогениды металлов являются типичными солями. Характеризуются ионным типом связи, где ионы металла имеют положительный заряд, а ионы галогена отрицательный. Имеют кристаллическую решетку.
Восстановительная способность галогенидов повышается в ряду Сl-, Br-, I- (см. §2.2).
Растворимость малорастворимых солей уменьшается в ряду AgCl — AgBr — AgI; в отличие от них, соль AgF хорошо растворима в воде. Большинство же солей галогеноводородных кислот хорошо растворимы в воде.
Дата добавления: 2016-01-03; просмотров: 6918;
