Оксид, гидроксид и соли алюминия. Комплексные соединения алюминия
Алюминий, оксид, гидроксид и соли алюминия. Комплексные соединения алюминия. Представление об алюмосиликатах

Физические и химические свойства алюминия. Получение алюминия
Алюминий — элемент III периода главной подгруппы III группы. Принадлежит к семейству р-элементов. Валентные электроны алюминия располагаются на s- и р-подуровнях внешнего электронного слоя. Этих электронов три, поэтому алюминий может образовывать три валентные связи, что для него наиболее типично. Поэтому для алюминия обычна степень окисления +3. В некоторых соединениях он имеет степени окисления +2 и +1.
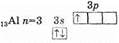
Природные соединения алюминия
Земная кора содержит 8,8% алюминия по массе. По распространенности в природе он занимает четвертое место среди всех элементов (после кислорода, водорода и кремния) и первое среди металлов. Важнейшие природные соединения алюминия — алюмосиликаты, бокситы, корунд и криолит.
Алюмосиликаты будут рассмотрены далее.
Бокситы — горная порода, состоящая главным образом из гидратированного оксида алюминия и оксидов железа, которые придают им красный цвет. Содержат от 30 до 60% Аl2O3. Из бокситов получают алюминий.
Корунд — минерал состава Аl2О3, обладает большой твердостью, его применяют как абразивный материал.
Криолит — минерал состава AlF3•3NaF или Na3AlF6. В настоящее время приготавливается искусственным путем, применяют в металлургии алюминия.
Получение
В промышленности алюминий получают электролизом раствора чистого Аl2О3 в расплавленном криолите Na3AlF6 с добавкой AlF3 и CaF2 при температуре 960°С. Криолит используется как растворитель оксида алюминия, кроме того, с добавкой CaF2 он позволяет поддерживать в электролитической ванне температуру плавления не выше 1000°С.
Первым этапом в переработке руд является их очистка от примесей, вторым этапом — тщательное обезвоживание оксида алюминия. Электролиз проводят в стальных электролитических ваннах, у которых имеется внешняя теплоизоляция и внутренняя футеровка из огнеупорного кирпича.
Внутри электролитическая ванна выложена графитовыми блоками, так как расплавленные фториды при высокой температуре растворяют обычную огнеупорную футеровку. Графитовые блоки в основании ванны вместе с расплавленным алюминием служат катодом, а аноды представляют собой угольные стержни, которые смонтированы так, чтобы они могли опускаться по мере их сгорания.
В первую очередь в электролизер загружают криолит и фторид кальция. После их расплавления (теплом, которое выделяется при пропускании электрического тока) добавляют чистый
Al2O3.
Процессы, протекающие при электролизе расплава Аl2О3 в криолите, можно представить следующим образом:
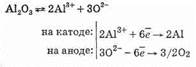
Выделяющийся на аноде кислород окисляет угольные стержни: О2+2С=2СО
2СО+О2=2СO2
I Именно поэтому конструкция электролитической ванны такова, что аноды можно опускать по мере их сгорания.
Во время электролиза образующийся металл периодически Удаляется со дна электролизера, он содержит обычно 98,5-99,8% алюминия, механические примеси (адсорбированные газы, электролит, оксид алюминия, уголь) и сплавы с элементами, которые встречаются в алюминиевых рудах (Si, Fe). Механические примеси и адсорбированные газы обычно удаляются переплавкой алюминия-сырца, а железо, кремний удаляют последующим
электролитическим рафинированием. После электролитического рафинирования получают алюминий чистоты 99,9%.
Физические свойства
Чистый алюминий представляет собой легкий серебристо-белый металл (плотность 2,7 г/см3 — почти в три раза легче железа), очень пластичный, ковкий и тягучий, температура плавления 660°С, температура кипения — 2452°С. После серебра и меди металлический алюминий — лучший проводник электричества и тепла.
Алюминий легко поддается обработке: прокатывается в фольгу, вытягивается в тонкую проволоку, отливается, легко образует сплавы. При 600°С алюминий становится хрупким и его можно истолочь в зерна или в порошок. Природный алюминий состоит из одного изотопа 2713Al(100%).
Химические свойства
По химическим свойствам алюминий принадлежит к числу весьма активных металлов, обладающих амфотерными свойствами. В ряду напряжений он стоит за щелочноземельными металлами. В чистом виде как на воздухе, так и в воде он может храниться очень долго, т.к. его поверхность со временем покрывается тонким и очень плотным оксидным слоем, который предохраняет его от окисления.
Если оксидную пленку разрушить (например, потереть поверхность алюминия наждачным порошком или опустить его ненадолго в горячий раствор щелочи), то алюминий будет взаимодействовать с водой:
2Al+6Н2О=2Аl(ОН)3+3H2
Будучи амфотерным элементом, алюминий в различных условиях ведет себя по-разному. В растворе щелочи алюминий вытесняет из воды водород, образуя соль алюминиевой кислоты — алюминат натрия (или калия), в котором он играет роль комплексообразователя:
2Аl+2NaOH+6Н2O=2Na[Al(OH)4]+3H2 Из кислоты алюминий вытесняет водород: 2Аl+6НСl=2АlСl3+3H2
В этом случае он проявляет металлические свойства. Концентрированные азотная и серная кислоты на холоду пассивируют металл (образуется защитная оксидная пленка), поэтому для хранения и перевозки азотной кислоты используют алюминиевую тару. В сильно разбавленном виде азотная кислота на алюми-
ний также не действует, а серная легко растворяет алюминий, особенно при нагревании.
Алюминий легко реагирует с галогенами:
2Аl+3Сl2=2АlСl3
При высоких температурах (700-2000°С) взаимодействует с серой, азотом, углеродом, образуя сульфид Al2S3, нитрид AlN и карбид алюминия Аl4С3 соответственно: 2Al+3S=Al2S3
2Аl+N2=2AlN 4Аl+3С=Аl4С3
Алюминий, введенный в пламя в виде стружки или порошка, ярко горит, выделяя большое количество энергии: 4Аl+3О2= 2Аl2О3
Эта особенность алюминия широко используется для получения различных металлов и неметаллов из оксидов путем восстановления их алюминием. Впервые метод восстановления металлов из их оксидов алюминием был применен русским ученым
Н. Н. Бекетовым и получил название алюминотермии.
Алюминотермией называют реакции, протекающие между
оксидами металлов и алюминием с образованием соответствующего свободного металла и оксида алюминия. Алюмотермией можно получить только те металлы, теплота образования оксидов
которых меньше теплоты образования оксида алюминия. Этим способом получают в промышленности такие металлы, как Cr, Mn, Ti,
W, а также Si:
Cr2O3+2Аl=2Cr+Аl2О3
Тонко измельченная смесь алюминия и железной окалины носит название термита (25% Fe3O4 и 75% Аl) и применяется для сварки различных металлических деталей, например рельсов. При поджигании термита происходит следующая реакция:
3Fe3O4+8Al=4Аl2О3+9Fe
При этом выделяется большое количество тепла и развивается высокая температура (до 3500°С). Поскольку температура плавления железа намного меньше этой температуры, то оно расплавляется и, выливаясь на рельсы, сваривает их.
Применение алюминия и его сплавов
Алюминий широко применяется в технике. Крупным потребителем его является авиационная промышленность: самолет состоит на 2/3 из алюминия и его сплавов, а авиационный мотор — на 1/4 из сплавов алюминия. Поэтому его называют крылатым
металлом. Из алюминия изготавливают кабели и провода. Учитывая коррозионную устойчивость алюминия, из него изготавливают детали аппаратов и тару для азотной кислоты. Корпуса автобусов, троллейбусов, цельнометаллических вагонов делают из алюминия и его сплавов. Из алюминия изготавливают упаковку для пищевых продуктов и посуду. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии. В производстве металлов алюминий занимает второе место после железа.
Оксид, гидроксид и соли алюминия. Комплексные соединения алюминия
Как уже отмечалось, алюминий способен проявлять переменную валентность. Наиболее типичны (их большинство) соединения, где валентность алюминия равна III.
Оксид алюминия (III) Аl2О3 (глинозем) — вещество белого цвета, тугоплавкое (tпл=2044°С, tкип=3530°С), практически нерастворимое в воде, с очень высокой твердостью. Является исходным сырьем для получения алюминия. В природе встречается в виде корунда и его разновидностей: сапфира (при окрашивании примесями в синий цвет), рубина (в красный) и аметиста (в фиолетовый цвет). Все они являются драгоценными камнями. Монокристаллы корунда — лазерный материал, рубинов — опорные камни часовых механизмов.
В лаборатории оксид алюминия получают, сжигая порошок алюминия в кислороде или прокаливая гидроксид алюминия:
4Аl+3О2 =2Аl2О3
2Аl(ОН)3=Аl2О3+3Н2О
Оксид алюминия не растворяется в воде и с ней не реагирует. Он амфотерен: взаимодействует с кислотами (правда, с большим трудом) и щелочами:
а) с соляной кислотой как основной оксид образует соли алюминия:
Аl2O3+6НСl=2АlСl3+3Н2О
б) с растворами щелочей с образованием гидроксокомплекса:
Аl2O3+2NaOH+7Н2O=2Na[Al(OH)4(H2O)2] Аl2О3+2OH-+7Н2O=2[Al(OH)4(H2O)2]-
в) с щелочами Аl2О3 лучше всего реагирует при сплавлении без воды, при этом получается соль метаалюминиевой кислоты:
Аl2О3+2NaOH=2NaAlO2+Н2О
Оксид алюминия взаимодействует также с карбонатами щелочных металлов (при сплавлении):
Аl2O3+Na2CO3=2NaAlO2+СО2 с кислыми солями (при сплавлении):
Аl2O3+6KHSO4=Al2(SO4)3+3K2SO4+3Н2O
Оксид алюминия применяют для получения абразивных материалов (корунд природный и искусственный), а также для получения огнеупорных материалов, из которых изготавливают тигли.
Гидроксид алюминия Аl(ОН)3 — белое студенистое вещество, плохо растворимое в воде, обладающее амфотерными свойствами.
Получают его косвенным путем — из солей алюминия действием на них растворами щелочей:
АlСl3+3NaОН=Аl(ОН)3 ¯+3NaCl Аl3++3ОН-=Аl(ОН)3dwn
или карбонатов щелочных металлов:
2АlСl3+3Na2CO3+3Н2О=2Аl(ОН)3¯+6NaCl+3СО2 Аl(ОН)3 выпадает в виде студенистого осадка белого цвета.
Гидроксид алюминия — типичный амфотерный гидроксид.
При взаимодействии с кислотами образуются соли, содержащие
| катионы алюминия, а с растворами щелочей (взятыми в избытке)
образуются алюминаты, т.е. соли, в которых алюминий входит в
состав аниона:
Аl(ОН)3+3Н+=Аl3++3Н2О
Аl(ОН)3+ОН-+2Н2О=[Аl(ОН)4(Н2O)2]-
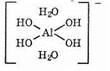
Растворение амфотерных гидроксидов в щелочных растворах
рассматривается как процесс образования гидроксосолей (гидроксокомплексов). Экспериментально доказано существование гидроксомплексов [Аl(ОН)4(Н2О)2]-, [Аl(ОН)6]3-, [Аl(ОН)5(Н2O)]2-; из них
первый — наиболее прочный. Координационное число алюминия
в этом комплексе равно 6, т.е. алюминий является шестикоординированным.
Диссоциацию амфотерного гидроксида алюминия в водном растворе более точно можно выразить уравнением:
Al3++3OH-« Al(OH)3=Al(OH)3+3Н2О«[Аl(ОН)4(Н2O)2]-+Н+
Следует заметить, что безводные алюминаты могут быть получены при сплавлении гидроксида алюминия С Щелочами или карбонатами:
2Аl(ОН)3+K2СO3=2КАlO2+CO2+3Н2О
Соли алюминия
Из гидроксида алюминия можно получить практически все соли алюминия. Почти все соли алюминия хорошо растворимы в воде; плохо растворяется в воде фосфат алюминия.
В растворе соли алюминия показывают кислую реакцию. Примером может служить обратимое воздействие с водой хлорида алюминия:
AlCl3+3Н2O«Аl(ОН)3+3НСl
Практическое значение имеют многие соли алюминия. Так, например, безводный хлорид алюминия АlСl3 используется в химической практике в качестве катализатора при переработке нефти, а также при получении толуола по реакции Фриделя-Крафтса:
В качестве катализаторов используются и другие галогениды алюминия.

Сульфат алюминия Al2(SO4)3•18Н2O применяется как коагулянт при очистке водопроводной воды, а также в производстве бумаги.
Широко используются двойные соли алюминия — квасцы KAl(SO4)2•12H2O, NaAl(SO4)2•12H2O, NH4Al(SO4)2•12H2O и др. — обладают сильными вяжущими свойствами и применяются при дублении кожи, а также в медицинской практике как кровоостанавливающее средство.
Дата добавления: 2016-01-03; просмотров: 11567;
