Физические свойства. Медь, серебро. Оксиды меди (I) и (II), оксид серебра (I)
Медь, серебро. Оксиды меди (I) и (II), оксид серебра (I). Гидроксид меди (II). Соли серебра и меди. Комплексные соединения серебра и меди
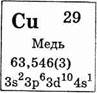
Медь
Медь Cu — химический элемент I группы побочной подгруппы периодической системы Д. И. Менделеева; атомный номер 29, атомная масса 63,546. Электронная конфигурация предвнешнего и внешнего электронных слоев меди выглядит следующим образом — 3s23p63d104sl. Медь — типичный металл, поэтому ее атомы связаны между собой металлической связью. Элемент представляет собой смесь двух изотопов с массовыми числами 63 (69,1%) и 65 (30,9%).
Распространенность в природе
Содержание меди в земной коре составляет 0,005%, что позволяет ей занимать лишь 23-е место среди всех элементов. Самородная медь в наше время составляет незначительную часть от общего производства металлов.
Подавляющая часть меди присутствует в горных породах в виде соединений. Из сотен минералов меди промышленное значение имеют немногие, в частности халькопирит — медный колчедан CuFeS2, халькозин — медный блеск Cu2S, ковеллин — CuS, малахит — CuСО3•Cu(ОН)2 и азурит — 2CuСO3•Cu(ОН)2.
Физические свойства
Медь — тяжелый розово-красный металл, мягкий и ковкий, плавится при температуре 1083°С, очень хорошо проводит электрический ток и теплоту: электрическая проводимость меди в 1,7 раза выше, чем алюминия, в 6 раз выше железа и лишь немного уступает электрической проводимости серебра.
Медь, серебро и золото составляют побочную подгруппу I группы периодической системы Менделеева. С щелочными металлами их сближает лишь способность образовывать одновалентные катионы. Для меди и ее аналогов характерно то, что они
могут давать соединения с валентностью, превышающей номер своей группы. Кроме того, элементы подгруппы меди, в отличие от щелочных металлов, склонны к комплексообразованию, образуют окрашенные соли, т.е. проявляют свойства, сближающие
их с никелем, палладием и платиной (побочная подгруппа VIII
группы).
Такое поведение Cu, Ag, Au объясняется конфигурацией внешних электронных оболочек их атомов. У атома меди самая подвижная наружная (4-я от ядра) оболочка содержит один s-электрон, ему предшествует десять d-электронов третьей от ядра оболочки (конфигурация 3d104s1).
Атомы меди и ее аналогов могут при образовании соединений терять не только самый внешний s-электрон, но и один или два d-электрона предшествующей оболочки, проявляя более высокую степень окисления. Для меди степень окисления +2 (валентность II) более характерна, чем +1 (валентность I).
Медь химически малоактивна и в чистом сухом воздухе не изменяется. Однако атмосфера, в которой мы живем, содержит водяные пары и углекислый газ, поэтому со временем медь покрывается зеленоватым налетом основного карбоната меди:
2Cu+O2+СО2+Н2О=Cu(ОН)2•CuСО3
При прокаливании на газовой горелке медь покрывается черным налетом оксида меди (II) CuO: 2Cu+O2=2CuO
Но если быстро опустить в воду раскаленный докрасна кусок меди, то на его поверхности образуется ярко-красная пленка Cu2O:
4Cu+O2=2Cu2O
Фтор, хлор, бром реагируют с медью, образуя соответствующие галогениды двухвалентной меди:
Cu+Сl2=CuСl2
При взаимодействии иода с нагретым порошком меди получается иодид одновалентной меди:
2Cu+I2=2CuI
Медь горит в парах серы:
Cu+S=CuS
В электрохимическом ряду напряжений металлов медь стоит правее водорода. Она не взаимодействует с водой, растворами щелочей, соляной и разбавленной серной кислотой. Однако в кислотах - сильных окислителях (например, азотной и концентрированной серной) медь растворяется:
3Cu+8HNO3(разб)=3Cu(NO3)2+2NO+4H2O
Cu+4HNO3(конц)=Cu(NO3)2+2NO2+2H2O
Cu+2Н2SO4(квнц)=CuSO4+SO2+2H2O
Медь растворяет водород, который существенно ухудшает ее механические свойства («водородная болезнь» меди).
Получение
Исходным сырьем для промышленного получения меди служат главным образом сульфидные руды, при этом считается рентабельным перерабатывать породы, содержащие более 1 % металла. Процесс получения меди из сульфидных руд относят к пирометаллургическим (протекающим при высокой температуре). Его можно упрощенно представить следующим образом: вначале сульфид меди (Cu2S) подвергают окислительному обжигу:
Cu2S+2О2=2CuO+SO2
К образовавшемуся оксиду меди (II) добавляют новую порцию сульфида. При высокой температуре протекает реакция:
2CuO+Cu2S=4Cu+SO2
Таким способом получают черновую медь (97-98% Си).
Применение
Высокая электро- и теплопроводность меди, ее пластичность и коррозионная стойкость определили направление использования металла в промышленности. Больше половины всей добываемой меди идет на производство электрических проводов. Так, чтобы передать трехфазный переменный ток на расстояние 1 км тремя медными проводами диаметром по 2 мм, необходимо 84 кг меди. В электровакуумной технике употребляется так называемая бескислородная (вакуумная) медь высокой чистоты. В технике сильных токов из меди изготавливают проводники с сечениями различной формы.
Высокая теплопроводность и сопротивление коррозии позволяют изготовлять из меди ответственные детали теплообменников, холодильников, вакуумных аппаратов, трубопроводов для перекачки масел и топлива и т.д. Что касается современного автомобиля, то он содержит 10-15 кг меди: из меди и ее сплавов делают радиаторы, маслоохладители, проводники тока.
Около 30-40% меди используют в виде различных сплавов.
Соединения меди обладают высокой биологической активностью. Они содержатся в животных и растительных организмах. В растениях медь участвует в процессах синтеза хлорофилла, поэтому она входит в качестве одного из компонентов в состав мик-
роудобрений. Медь входит в состав многих продуктов, которые человек использует в пищу, например, в молоко. Недостаточное употребление меди может привести к различным заболеваниям, в частности, ухудшается состав крови. Однако избыток соединений меди также вреден — он может привести к тяжелым отравлениям. Поэтому не рекомендуется пользоваться при приготовлении пищи медной посудой: при кипячении в ней в раствор может перейти избыточное количество меди. Можно лишь использовать медную посуду, покрытую внутри слоем олова.
15.2. Соединения меди: оксид меди (I) и (II), гидроксид меди (II). Соли и комплексные
Соединения меди
Оксид меди (I) Cu2O. Если погрузить в холодную воду раскаленный докрасна кусок меди, то на его поверхности образуется ярко-красная пленка Cu2O. Обычные образцы меди содержат сотые доли Си2О. При нагревании такого металла в атмосфере, содержащей водородные и некоторые другие газы (СО, СН4), происходит восстановление Cu2O:
Cu2О+Н2=2Cu+Н2О Cu2O+СО=2Cu+СO2
Образовавшиеся пары воды и углекислый газ выделяются из металла, вызывая появление трещин. А это резко ухудшает механические свойства меди.
Соединения меди (I) менее устойчивы, чем соединения меди (II); в водных растворах они легко подвергаются диспропорционированию (реакции самоокисления-самовосстановления):
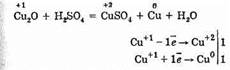
Оксид меди (II) CuO представляет собой кристаллы черного цвета. Его обычно получают из металлической меди путем прокаливания на воздухе, а также разложения солей, например:
(CuОН)2СО3=2CuO+Н2O+СО2
Оксид меди (II) — основной оксид, при обычных условиях весьма устойчивый. При небольшом нагревании он довольно
легко восстанавливается водородом или углеродом до металлической меди:
CuO+С=Cu+СО CuO+Н2=Cu+Н2О
С водой оксид меди (II) не реагирует, поэтому соответствующее основание — гидроксид меди Cu(ОН)2 — не образуется путем взаимодействия оксида с водой.
Гидроксид меди (II) Cu(ОН)2 выпадает в виде объемистого голубого осадка при действии щелочей на растворы солей двухвалентной меди:
CuСl2+2NaOH=Cu(OH)2¯+2NaCl
Это слабое нерастворимое основание, легко вступает во взаимодействие с кислотами с образованием солей:
Cu(ОН)2+H2SO4=CuSO4+2Н2О Cu(OH)2+2H+=Cu2++2Н2О
Свежеосажденный гидроксид меди (II) Cu(OH)2 растворяется и в концентрированных растворах щелочей, но его кислотный характер выражен слабо:
Cu(OH)2+2NaOH=Na2[Cu(OH)4]
Гидроксид меди (II) Cu(ОН)2 легко растворяется в водных растворах аммиака, образуя раствор ярко-синего цвета. Этот раствор нередко применяют в органической химии для разного рода качественных реакций, а также иногда для обработки целлюлозы:
Cu(OH)2+4NH3=[Cu(NH3)4](OH)2
Гидроксид меди (II) Cu(ОН)2 разлагается при нагревании выше 70-90°С:
Cu(OH)2=CuO+H2O
При этом он чернеет, постепенно превращаясь в оксид меди (II)CuO.
. Соли меди (II) нашли широкое применение в народном хозяйстве. Особенно важным является медный купорос — кристаллогидрат сульфата меди (II) CuSO4•5Н2О. Медный купорос используется в производстве минеральных и органических красителей, в медицинской промышленности, для пропитки древесины в качестве антисептика (предохраняет дерево от гниения). Большое значение имеет медный купорос в сельском хозяйстве: им про-
травливают семена перед посевом, опрыскивают деревья и кустарники для борьбы с вредителями.
Для ионов меди (II) Cu2+ характерно образование комплексных соединений, например K2[Cu(CN)4] — тетрацианокупрат (II) калия:
CuСl2+4KCN«K2[Cu(CN)4]+2KCl
Из других комплексных соединений меди (II) отметим соединение с аммиаком. Если к раствору хлорида меди (II) прилить небольшое количество раствора аммиака, то выпадет осадок гидроксида меди (II):
CuСl2+2NH3+2Н2О=Cu(OH)2+2NH4Cl
Если добавить избыток аммиака, то гидроксид растворится с образованием комплексного соединения темно-синей окраски, характерной для аммиачного комплекса меди:
Cu(OH)2+4NH3=[Cu(NH3)4](OH)2
Эта реакция является качественной на ион меди (II). Растворимость гидроксида меди (II) в щелочах также связана собразованием комплексных соединений: Cu(OH)2+2NaOH=Na2[Cu(OH)4]
Образованием комплексных соединений объясняется цвет растворов солей меди (II).
Безводный сульфат меди — вещество белого цвета, а раствор этой соли имеет голубую окраску.
При растворении происходит химическое взаимодействие ионов соли с водой, и образуются так называемые аквакомплексы меди, имеющие голубую окраску:
CuSO4+6Н2О=[Cu(H2O)6]SO4

Дата добавления: 2016-01-03; просмотров: 4053;
