Положение металлов в периодической системе. Физические свойства
В периодической системе Д. И. Менделеева из 110 элементов 87 являются металлами. Они находятся в I, II, III группах, в побочных подгруппах всех групп. Кроме того, металлами являются наиболее тяжелые элементы IV, V, VI и VII групп. Однако многие металлы обладают амфотерными свойствами и иногда могут вести себя как неметаллы. Особенностью строения атомов металлов является небольшое число электронов во внешнем энергетическом уровне, не превышающее трех. Атомы металлов имеют, как правило, большие атомные радиусы. В периодах наибольшие атомные радиусы у щелочных металлов. Они наиболее химически активны, т.е. атомы металлов легко отдают электроны и являются хорошими восстановителями. Лучшие восстановители — металлы I и II групп главных подгрупп. В соединениях металлы всегда проявляют положительную степень окисления, обычно от +1 до +4. В соединениях с неметаллами типичные металлы образуют химическую связь ионного характера. В виде простого вещества атомы металлов связаны между собой так называемой металлической связью.
Металлическая связь — особый вид связи, присущий исключительно металлам. Сущность ее в том, что от атомов металла постоянно отрываются электроны, которые перемещаются по всей массе куска металла.
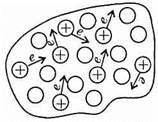
Атомы металла, лишенные электронов, превращаются в положительные ионы, которые снова притягивают к себе движущиеся электроны. Одновременно другие атомы металла отдают электроны. Таким образом, внутри куска металла постоянно циркулирует так называемый электронный газ, который прочно связывает между собой все атомы металла. Электроны оказываются как бы обобществленными всеми атомами металла. Такой особый тип химической связи между атомами металлов обуславливает как физические, так и химические свойства металлов.
Металлы обладают рядом сходных физических свойств, отличающих их от неметаллов. Чем больше валентных электронов имеет металл, тем прочнее кристаллическая решетка, тем прочнее и тверже металл, тем выше его температура плавления и кипения и т.д.
Все металлы обладают более или менее ярко выраженным блеском, который принято называть металлическим, и непрозрачностью, что связано с взаимодействием свободных электронов с падающими на металл квантами света. Металлический блеск характерен для куска металла в целом. В порошке металлы темного цвета, за исключением серебристо-белых магния и алюминия. Алюминиевая пыль используется для изготовления краски «под серебро». Многие металлы обладают жирным или стеклянным блеском.
Цвет металлов довольно однообразен: он либо серебристо-белый (алюминий, серебро, никель), либо серебристо-серый (железо, свинец). Только золото желтого цвета, а медь — красного. По технической классификации металлы делятся условно на черные и цветные. К черным относятся железо и его сплавы. Все остальные металлы называются цветными.
Все металлы, за исключением ртути, — твердые вещества с кристаллической структурой, поэтому температуры плавления их выше нуля, только температура плавления ртути -З9°C. Наиболее тугоплавким металлом является вольфрам (3380°С). Металлы, плавящиеся при температуре выше 1000°С, называют тугоплавкими, ниже — легкоплавкими.
Металлы обладают различной твердостью. Самый твердый металл — хром (режет стекло), а самые мягкие — калий, рубидий, цезий. Они легко режутся ножом.
Металлы более или менее пластичны (обладают ковкостью). Наиболее ковким металлом является золото. Из него можно выковать фольгу толщиной 0,0001 мм — в 500 раз тоньше человеческого волоса. Однако не обладают пластичностью Mn и Bi — это хрупкие металлы.
Пластичностью называют способность к сильной деформации без нарушения механической прочности. При воздействии, вызывающем смещение частиц тела с ионной или атомной решеткой, происходит разрыв направленных связей, и тело разрушается. У металлов же связи образуются за счет электронного газа. Они не имеют направленности. Поэтому сохраняется целостность куска металла при изменении формы. Пластичность металлов используется при их прокате.
По плотности металлы разделяются на тяжелые и легкие. Тяжелыми считаются те, плотность которых больше 5 г/см . Самым тяжелым металлом является осмий (22,61 г/см ). Наиболее легкие металлы — литий, натрий, калий (плотность меньше единицы). Плотность металла тем меньше, чем меньше атомная масса элемента-металла и чем больше радиус его атома. Широкое применение в промышленности получили легкие металлы — магний и алюминий.
Металлы характеризуются высокой электро- и теплопроводностью. Наиболее электро- и теплопроводно серебро, на втором месте стоит алюминий. Металлы с высокой электропроводностью имеют и высокую теплопроводность. Теплопроводность обуславливается высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры в массе тела. Хорошая электропроводность металлов объясняется присутствием в них свободных электронов, которые под влиянием даже небольшой разницы потенциалов приобретают направленное движение от отрицательного полюса к положительному.
Металлы проявляют магнитные свойства. Хорошо намагничиваются железо, кобальт, никель и их сплавы. Такие металлы и сплавы называются ферромагнитными.
Дата добавления: 2016-01-03; просмотров: 1709;
