Получение и химические свойства металлов. Коррозия
Некоторые металлы в природе могут встречаться в самородном состоянии. Это в основном благородные металлы, например золото. Его извлекают путем механического отмывания от окружающих пород. Однако подавляющее большинство металлов (те, которые находятся в левой части ряда напряжений) находятся в природе в виде соединений.
Природные минералы, содержащие в своем составе металлы и пригодные для промышленного получения металлов, называют рудами. При получении любого металла необходимо:
1) отделить руду от пустой породы;
2) восстановить металл из соединения.
В зависимости от способа получения металл различают пирометаллургию, гидрометаллургию и электрометаллургию.
Пирометаллургия охватывает способы получения металлов из их оксидов. В тех случаях, когда руда представляет собой соль, например сульфид цинка, ее предварительно переводят в оксид:
2ZnS+3O2=2ZnO+2SO2
В качестве восстановителей металлов из их оксидов используют углерод, оксид углерода (II), водород, метан:
Cu2O+С=2Cu+СО
Восстановление углем (коксом) проводят обычно тогда, когда получаемые металлы совсем не образуют карбидов или образуют непрочные карбиды; таковы железо и многие цветные металлы.
Восстановление металлов из их соединений другими металлами называют металлотермией. Эти процессы протекают также при высоких температурах. В качестве восстановителей используют алюминий, магний, кальций, натрий, а также кремний.
Если восстановителем является алюминий, то процесс называется алюмотермией, если магний — магнийтермией:
Cr2О3+2Аl=2Cr+Аl2O3 ТiCl4+2Mg=Ti+2MgCl2
Металлотермией обычно получают те металлы (и их сплавы), которые при восстановлении их оксидов углем образуют карбиды. Это — марганец, хром, титан, молибден, вольфрам и др.
Иногда металлы восстанавливают из оксидов водородом (водородотермия):
МоO3+3Н2=Мо+3Н2О
Гидрометаллургия охватывает способы получения металлов из их солей. В этом случае элемент металла, входящего в состав руды, сначала переводят в растворимую соль с помощью соответствующего реагента и только после этого из раствора непосредственно извлекают металл.
В настоящее время гидрометаллургическим способом добывают такие металлы, как медь, серебро, цинк, уран и др. Многие медные руды содержат оксид меди. Такую руду обрабатывают
разбавленной серной кислотой и переводят в сульфат меди, растворимый в воде:
CuO+H2SO4=CuSO4+Н2О
После этого из сульфата меди медь извлекают либо электролизом, либо вытесняют с помощью железа: CuSO4+Fe=Cu+FeSO4
Электрометаллургия охватывает способы получения металлов с помощью электролиза. Этим способом получают главным образом легкие металлы — алюминий, натрий и другие — из их расплавленных оксидов или хлоридов.
Химические и физические свойства металлов определяются атомной структурой и особенностями металлической связи. Все металлы отличаются способностью легко отдавать валентные электроны. В связи с этим металлы проявляют ярко выраженные восстановительные свойства. Степень восстановительной активности металлов отражает ряд напряжений.
Зная положение металла в этом ряду, можно сделать вывод о сравнительной величине энергии, затрачиваемой на отрыв от атома валентных электронов. Чем ближе к началу ряда, тем легче окисляется металл. Наиболее активные металлы вытесняют водород из воды при обычных условиях с образованием щелочи:
2Na+2Н2O=2NaOH+H2
Менее активные металлы вытесняют водород из воды в виде перегретого пара и образуют оксиды:
2Fe+4H2O=Fe3O4 +4H2
Реагируют с разбавленными и бескислородными кислотами, вытесняя из них водород:
Zn+2HCl=ZnCl2+H2
Металлы, стоящие в ряду напряжений после водорода, не могут вытеснять его из воды и из кислот, а вступают с кислотами-окислителями в окислительно-восстановительные реакции без вытеснения водорода:
Cu+2H2SO4 (конц)=CuSO4+SO2+Н2O
Все предшествующие металлы вытесняют последующие за ними в ряду напряжений из их солей: Fe+CuSO4=FeSO4+Cu
Во всех случаях вступающие в реакции металлы окисляются. Окисление металлов наблюдается и при непосредственном взаимодействии металлов с неметаллами:
2Na+S=Na2S 2Fe+3Cl2=2FeCl3
Большинство металлов активно реагируют с кислородом, образуя оксиды разного состава.
Окисление металлов часто приводит к их разрушению. Разрушение металлов под действием окружающей среды называется коррозией. Различают два основных типа коррозии: химическую и электрохимическую.
Химической коррозией называется разрушение металла окислением его в окружающей среде без возникновения электрического тока в системе. При этом происходит взаимодействие металла с составными частями среды — с газами и неэлектролитами.
Так, железо на воздухе ржавеет — покрывается тонкой пленкой оксидов (FeO, Fe2O3 или Fe3O4 в зависимости от условий). Еще более энергично происходит окисление железа в присутствии воды:
4Fe+3O2+6Н2O = 4Fe(OH)3
С повышением температуры химическая коррозия увеличивается.
Большой вред различным сооружениям приносит коррозия под действием веществ при высоких температурах в технике (в металлургии, сопла ракетных двигателей, в газовых турбинах). Некоторые металлы, например алюминий, при действии на них кислорода или других окислителей (концентрированной HNO3) образуют защитную пленку, которая препятствует дальнейшему контакту металла с окислителем и предохраняет таким образом металл от дальнейшей коррозии.
Электрохимической коррозией называется разрушение металла в результате возникновения гальванической пары и появления внутри системы электрического тока. Электрохимическая коррозия возникает при контакте двух металлов посредством электролита, электродами при этом являются сами металлы.
При возникновении гальванической пары появляется электрический ток тем большей силы, чем дальше стоят друг от друга металлы в ряду напряжений. При этом поток электронов идет от более активного металла к менее активному; более активный металл в этом случае разрушается (корродирует).
Например, при возникновении гальванической пары цинк — медь корродирует цинк.
Возьмем цинковую и медную пластинки и опустим их в раствор серной кислоты, которая содержится в растворе в виде ионов:
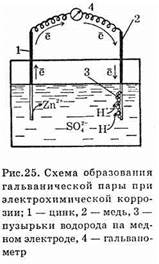
Атомы цинка, отдавая электроны в виде ионов, переходят в раствор:
Zn°-2e-®Zn+2
Электроны через проводник переходят на медь, а с меди — на ионы водорода:
Н++e-®Н°
Водород в виде нейтральных атомов выделяется на медной пластинке, а цинк постепенно растворяется. Таким образом, медь, как бы оттягивая электроны с цинка, заставляет последний быстрее растворяться, т.е.
способствует окислению (см. рис. 25).
Электрохимическая коррозия протекает в присутствии как сильных, так и слабых электролитов, однако в присутствии сильных электролитов скорость коррозии выше.
С точки зрения электрохимической коррозии становится понятным, почему коррозия увеличивается в том случае, если в металле присутствуют примеси. Металл и примесь образуют гальваническую пару, в результате чего разрушается металл. Именно в тех случаях, когда требуется очень высокая химическая устойчивость металлов, добиваются их высокой чистоты.
Вследствие того, что коррозия наносит народному хозяйству огромный ущерб, разрабатываются различные методы защиты от коррозии. В настоящее время применяются следующие основные методы защиты от коррозии.
1. Поверхностное покрытие металлов, которое изолирует металл от внешней среды.
Покрытия могут быть металлические (цинк, медь, никель, хром) и неметаллические (лаки, краски, эмали).
Воронение — это процесс, при котором железо подвергается действию сильных окислителей, в результате чего металл покрывается непроницаемой для газов оксидной пленкой, предохраняющей его от воздействия внешней среды.
2. Создание сплавов, стойких к коррозии, введение в состав стали хрома, марганца, никеля дает возможность получить нержавеющую сталь, находящую широкое применение в промышленности.
Вещества, замедляющие коррозию, а иногда и практически полностью останавливающие ее, называются ингибиторами — замедлителями. Характер действия ингибиторов различен. Они либо создают на поверхности металлов защитную пленку, либо уменьшают агрессивность среды.
Сплавы
Сплавами называют системы, состоящие из двух или более металлов, а также металлов и неметаллов. Свойства сплавов самые разнообразные и отличаются от исходных компонентов. Химическая связь в сплавах металлическая. Поэтому они обладают металлическим блеском, электрической проводимостью и другими свойствами металлов.
Сплавы получают смешением металлов в расплавленном состоянии, они затвердевают при последующем охлаждении. При этом возможны следующие типичные случаи.
1. Металлы смешивают и расплавляют с последующим затвердеванием. При этом составляющие сплав компоненты ограниченно или неограниченно растворяются друг в друге. Сюда относятся металлы, кристаллизующиеся в однотипных решетках и имеющие близкие по размерам атомы, например Ag-Cu, Cu-Ni, Ag-Au и другие. При охлаждении таких расплавов получаются твердые растворы. Кристаллы последних содержат атомы обоих металлов, чем обуславливается их полная однородность. По сравнению с истинными металлами твердые растворы характеризуются более высокой прочностью, твердостью и химической стойкостью; они пластичны и хорошо проводят электрический ток.
2. Расплавленные металлы смешиваются между собой в любых отношениях, однако при охлаждении твердый раствор не образуется. При затвердевании таких сплавов получается масса, состоящая из мельчайших кристалликов каждого из металлов. Это характерно для сплавов Pb-Sn, Bi-Cd, Ag-Pb и др.
3. Расплавленные металлы при смешении взаимодействуют друг с другом, образуя интерметаллиды. Примером могут служить соединения некоторых металлов с сурьмой: Na3Sb, Ca3Sb2, NiSb и т.д.
В настоящее время некоторые сплавы готовят методом порошковой металлургии. Берется смесь металлов в виде порошков, прессуется под большим давлением и спекается при высокой тем-
пературе в восстановительной среде. Таким путем получают сверхтвердые сплавы.
Дата добавления: 2016-01-03; просмотров: 3115;
