Потенциал ионизации
Что называется энергией ионизации?
Энергия ионизации элемента — энергия, необходимая для превращения 1 моля атомов в газовой фазе в 1 моль катионов в газовой фазе таким образом, чтобы от каждого атома отрывался один электрон.
А(r)®А+(r)+ё-
Энергию ионизации можно определить путем бомбардировки атомов электронами, ускоренными в электрическом поле. То наименьшее напряжение поля, при котором скорость электронов становится достаточной для ионизации атомов, называется потенциалом ионизации атомов данного элемента и выражается в электронвольтах.
При затрате достаточной энергии можно оторвать от атома два, три и более электронов. Поэтому говорят о первом потенциале ионизации (энергия отрыва от атома первого электрона), втором потенциале ионизации (энергия отрыва второго электрона) и т. д.
По мере последовательного удаления электронов от атомов положительный заряд образующегося иона возрастает. Поэтому для отрыва каждого следующего электрона требуется большая затрата энергии, — иначе говоря, последовательные потенциалы ионизации атомов возрастают.
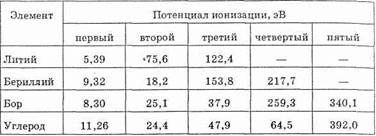
Данные таблицы 1 показывают, что от атома лития сравнительно легко отрывается один электрон, от атома бериллия — два, от атома бора — три, от атома углерода — четыре. Отрыв же последующих электронов требует гораздо большей затраты энергии. Это соответствует нашим представлениям о строении рассматриваемых атомов. Действительно, у атома лития во внешнем электронном слое размещается один электрон, а у атома бериллия — 2, бора — 3, углерода — 4. Эти электроны обладают более высокой энергией, чем электроны предшествующего слоя, и поэтому их отрыв от атома требует сравнительно небольших энергетических затрат. При переходе же к следующему электронному слою энергия ионизации резко возрастает.
Величина потенциала ионизации может служить мерой большей или меньшей «металличности» элемента: чем меньше потенциал ионизации, тем легче оторвать электрон от атома, тем сильнее должны быть выражены металлические свойства элемента.
Таблица 1.
Последовательные потенциалы ионизации атомов некоторых элементов второго периода
Рассмотрим с этой точки зрения, как изменяются первые потенциалы с увеличением атомного номера у атомов одной и той же подгруппы периодической системы (табл. 2).
Как видно, с увеличением порядкового номера элемента потенциалы ионизации уменьшаются, что свидетельствует об усилении металлических и, соответственно, ослаблении неметаллических свойств.
Эта закономерность связана с возрастанием радиусов атомов. Кроме этого, увеличение числа промежуточных электронных слоев, расположенных между ядром атома и внешними электронами, приводит к более сильному экранированию ядра, т.е. к уменьшению его эффективного заряда. Оба эти фактора (растущее удаление внешних электронов от ядра и уменьшение его эффективного заряда) приводят к ослаблению связи внешних электронов с ядром и, следовательно, к уменьшению потенциала ионизации.
У элементов одного и того же периода при переходе от щелочного металла к благородному газу заряд ядра постепенно возрастает, а радиус атома уменьшается. Поэтому потенциал ионизации
Таблица 2.
Первые потенциалы ионизации (в эВ) атомов элементов некоторых главных подгрупп
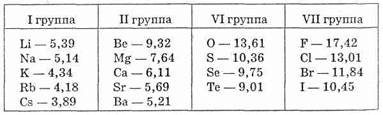
Таблица 3.
Потенциалы ионизации (в эВ) атомов второго и третьего периодов
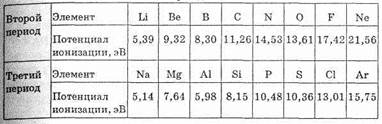
постепенно увеличивается, а металлические свойства ослабевают. Иллюстрацией этой закономерности могут служить первые потенциалы ионизации элементов второго и третьего периодов (табл. 3).
Из данных табл. 3 видно, что общая тенденция к возрастанию энергии ионизации в пределах периода в некоторых случаях нарушается. Так, потенциалы ионизации атомов бериллия и азота выше, чем атомов следующих за ними элементов бора и кислорода; аналогичное явление наблюдается и в третьем периоде при переходе от магния к алюминию и от фосфора к сере. При этом повышение значения потенциалов ионизации наблюдается либо у атомов с целиком заполненным внешним энергетическим подуровнем (бериллий и магний):

либо у атомов, у которых внешний энергетический подуровень заполнен ровно наполовину, так что каждая орбиталь этого подуровня занята одним электроном (азот и фосфор):

Эти и подобные факты служат экспериментальным основанием, согласно которому электронные конфигурации, соответствующие полностью или ровно наполовину занятым подуровням, обладают повышенной энергетической устойчивостью.
6.3.3. Сродство атома к электрону
Как отмечалось выше, атомы могут не только отдавать, но и присоединять электроны. Энергия, выделяющаяся при присоединении электрона к свободному атому, называется сродством к электрону. Сродство к электрону, как и энергию ионизации,
обычно выражают в электронвольтах. Так, сродство к электрону атома водорода равно 0,75 эВ, а кислорода — 1,47 эВ, фтора — 3,52 эВ.
Сродство к электрону атомов металлов, как правило, близко к нулю или отрицательно; из этого следует, что для атомов большинства металлов присоединение электронов энергетически невыгодно. Сродство же к электрону атомов неметаллов всегда положительно и тем больше, чем ближе к благородному газу расположен неметалл в периодической системе; это свидетельствует об усилении неметаллических свойств по мере приближения к концу периода (см. стр. 42).
6.3.4. Электроотрицательность
Электроотрицательностью (ЭО) атома называется способность атома в молекуле (соединении) притягивать электроны, связывающие его с другими атомами.
Понятие электроотрицательности ввел Л. Полинг (США, 1932 г.). Количественная характеристика электроотрицательности атома весьма условна и не может быть выражена в единицах каких-либо физических величин, поэтому для количественного определения ЭО предложено несколько шкал. Наибольшее признание и распространение получила шкала относительных ЭО, разработанная Л. Полингом (см. табл. 4).
По шкале Л. Полинга ЭО фтора (наиболее электроотрицательного из всех элементов) условно принята равной 4,0; на втором месте находится кислород, на третьем — азот и хлор. Водород и типичные неметаллы находятся в центре шкалы; значения их ЭО близки к 2.
Большинство металлов имеют значения ЭО, приблизительно равные 1,7 или меньше. Отметим, что ЭО является безразмерной величиной.
Таблица 4. Значения электроотрицательности элементов по Полингу
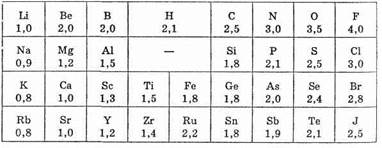
Таблица 5.
Соотношение между разностью электроотрицательности и степенью ионности связи
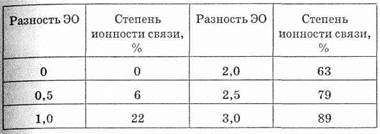
Нетрудно обнаружить интересную закономерность — шкала Полинга в общих чертах напоминает периодическую систему элементов. Эта шкала позволяет дать оценку степени ионности (полярности) связи. Для этого используют зависимость между разностью ЭО и степенью ионности связи (табл. 5).
Из табл. 5 следует, что чем больше разность ЭО, тем больше степень ионности. Разность ЭО, равная 1,7, соответствует 50% -ному ионному характеру связей, поэтому связи с разностью ЭО больше 1,7 могут считаться ионными. Связи с меньшей разностью относят к ковалентным полярным.
К сведению абитуриента!
Для количественной характеристики предложено считать мерой электроотрицательности энергию, равную арифметической сумме энергии ионизации атома (Г) и сродства к электрону (E), т.е.
X=I+E,
где X — электроотрицательность атома, а значит, и элемента.
В качестве примера определим X для фтора и лития. Из справочных таблиц найдем, что IF=17,42 эВ, EF=3,62 эВ, ILi=5,39 эВ, ELi=0,22 эВ (вычислено косвенным путем). Тогда ХF=17,42+3,62=21,04 эВ, а ХLi=5,39+0,22=5,61 эВ.
Фтор имеет наибольшее значение I+E, поэтому он является наиболее электроотрицательным элементом. Наименьшее значение электроотрицательности имеют атомы щелочных металлов.
Обычно электроотрицательность лития принимают за единицу и сравнивают с ней электроотрицательность других элементов. Тогда получают простые и удобные для сравнения значения относительней электроотрицательности элементов (будем ее обозначать через х):
xLi=1; xF=21,04/5,61» 4 и т.д.
В настоящее время получила широкое распространение таблица относительных электроотрицательностей, при составлении которой использованы последние данные об электронном строении атомов и их радиусах.
Необходимо отметить, что приводимые в разных книгах по химии значения относительной электроотрицательности несколько отличаются. Это объясняется тем, что они рассчитывались различными методами исходя из определенных допущений и предположений.
6.3.5. Полярность связи, индуктивный эффект
Двухатомные молекулы могут быть гомоядерными (состоят из одинаковых атомов) и гетероядерными (состоят из различных атомов). В гомоядерной молекуле H2 из-за волновых свойств электронов имеется определенная вероятность того, что оба электрона будут находиться у одного ядра, например В H+H-. Но одинаково вероятно и состояние Н-Н+. Поэтому в среднем эти состояния компенсируются, и электронное облако связи симметрично относительно плоскости, проходящей через середину линии связи перпендикулярно этой линии. Соответственно эффективные заряды атомов равны нулю.
Напомним!
Эффективный заряд атома в соединении (d) — это реальный заряд на атоме в соединении.
Его можно определить экспериментально (чаще всего это делают при помощи рентгеноспектрального метода). Точность определения эффективного заряда атома в соединении невелика, поскольку электронное облако нельзя четко разделить между ядрами атомов. Однако все методы показывают, что эффективные заряды атомов в соединении малы: положительный эффективный заряд не превышает +2, а отрицательный заряд бывает только до -1. Например, в сульфатах dS »(+1,5) — (+2,0); в оксидах dO »-1. С увеличением степени окисления (при одинаковых ближайших атомах окружения) эффективный заряд обычно растет, например в гексафторохромате калия K3CrF6 dCr=+1,4, а в хромате калия K2CrO4 dCr = +1,95. Однако ковалентный характер связи при этом увеличивается, так как возрастает разность между эффективным и предельно ионным зарядами (+3 и +6 в приведенных примерах). Таким образом, чисто ионная связь практически никогда не образуется. Зато во всех случаях осуществляется обоб-
ществление электронов, хотя бы частичное, т.е. образуется ковалентная связь.
В том случае, когда эффективные заряды атомов равны нулю, связь называется неполярной (иногда ее называют гомеополярной).
Аналогично образуется связь между разными атомами, например Н 1s1 и Сl 3s23px23py23pz1. Неспаренные электроны атомов Н и Сl образуют общее электронное облако. Однако вероятность состояний Н+Сl-и Н-Сl+ различна, в результате электронное облако связи смещено к одному из атомов, и атомы приобретают эффективные заряды: Hd+Сld-.
Молекула НС1 представляет собой диполь, а связь является полярной.
Итак, молекула НС1 — полярная молекула. Ее можно рассматривать как систему из двух равных по абсолютной величине, но противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга. Такие системы называют электрическими диполями. Хотя суммарный заряд диполя равен нулю, в окружающем его пространстве образуется электрическое поле.
Напряженность этого поля пропорциональна дипольному моменту молекулы и, представляющему собой произведение абсолютного значения заряда электрона q на расстояние l между центрами положительного и отрицательного зарядов в молекуле:
m=ql
Дипольный момент молекулы служит количественной мерой ее полярности. Дипольный момент молекулы обычно измеряют в Дебаях (Д). Эта единица измерения названа так по имени голландского физика П. Дебая. 1Д = 3,33•10-30 Кл•м.
Молекула тем более полярна, чем больше смещена общая электронная пара к одному из атомов, т.е. чем выше эффективные заряды атомов и чем больше длина диполя l. Поэтому в ряду сходно построенных молекул дипольный момент возрастает по мере увеличения разности электроотрицательности атомов, образующих молекулу. Например, дипольные моменты НС1, HBr, HI равны соответственно 1,04; 0,79; 0,38 Д, что связано с уменьшением разности ЭО атомов при переходе от НСl к HBr и HI (см. табл. 4).
Итак, полярной связью называется химическая связь, обладающая дипольным моментом; дипольный момент неполярной связи равен нулю.
Полярные связи обычно реакционноспособнее, чем неполярные.
Введение понятия полярности связи позволяет объединить все случаи химической связи как ковалентные (в широком смысле слова), основанные на обобществлении (в любой степени) электронов. Таким образом, ковалентная связь — это химическая связь, обусловленная обобществлением электронов.
6.3.6. Кратные связи
Согласно принципу локализованных электронных пар метода валентных связей одинарной связью называется химическая связь, осуществляемая одной электронной парой. Одинарные связи практически всегда представляют собой s-связи. s-связью называется химическая связь, по которой через линию связи не проходит ни одной узловой плоскости. Между двумя атомами может образовываться только одна s-связь.
То, что между двумя атомами может образовываться только одна s-связь, отнюдь не означает, что между ними не может быть образована дополнительная связь.
Химическая связь, осуществляемая более чем одной электронной парой, называется кратной связью.
Кратность (порядок) связи — это число общих электронных пар, участвующих в образовании связи.
Кратная связь может быть двойной, тройной, иметь более высокую кратность и даже дробную кратность. Кратная связь состоит из одной s-связи, p-связи и иногда d-связи.
В качестве примера рассмотрим строение молекулы азота N2:
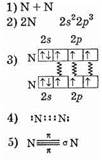
В молекуле азота между двумя атомами азота имеются три связи: одна s-связь и две p-связи.
Следует быть осторожным в утверждении, что данная связь кратная. Кратность связи часто нельзя определить при чисто качественном рассмотрении. Наиболее просто кратность связи определяется по энергии и длине связи. Чем выше кратность связи, тем больше энергия связи. Например, средние значения длин
связи углерод-углерод следующие: d(C—sС ) 0,154 нм; d(C=psС)0,134 нм; d(CºppsC) 0,120 нм.
Данные показывают, что первая p-связь уменьшает длину связи на 0,020 нм, тогда как вторая только на 0,014 нм. Это общее правило: вторая p-связь укорачивает связь в меньшей степени, чем первая p-связь. Из зависимости длины связи от кратности можно определить кратность связи в соединении по экспериментальному значению длины связи.
6.3.7. Модель гибридизации орбиталей
Известно, что при образовании молекулы вместо исходных атомных s-, р- и d-электронных облаков образуются такие равноценные «смешанные» или гибридные электронные облака, которые вытянуты по направлению к соседним атомам, благодаря чему достигается их более полное перекрывание с электронными облаками этих атомов.
Такая деформация электронных облаков требует затраты энергии. Но более полное перекрывание валентных электронных облаков приводит к образованию более прочной химической связи и, следовательно, к дополнительному выигрышу энергии. Если этот выигрыш энергии достаточен, чтобы с избытком скомпенсировать затраты энергии на деформацию исходных атомных электронных облаков, — такая гибридизация приводит в конечном счете к уменьшению потенциальной энергии образующейся молекулы и, следовательно, к повышению ее устойчивости.
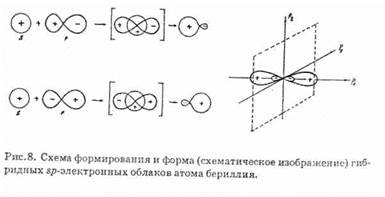
Рассмотрим в качестве примера гибридизации образование молекулы фторида бериллия BeF2. Каждый атом фтора, входящий в состав этой молекулы, обладает одним неспаренным электроном:

который и участвует в образовании ковалентной связи. Атом бериллия в невозбужденном состоянии (1s22s2) неспаренных электронов не имеет:
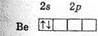
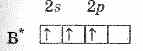
Поэтому для участия в образовании химических связей атом бериллия должен перейти в возбужденное состояние (1s22s12p1):
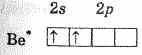
Образовавшийся возбужденный атом Be обладает двумя неспаренными электронами: электронное облако одного из них соответствует состоянию 2s, другого — 2р. При перекрывании этих электронных облаков с р-электронными облаками двух атомов фтора могут образоваться ковалентные связи.
Форма и расположение этих орбиталей показаны на рис. 8, из которого видно, что гибридные sp-орбитали вытянуты в противоположных направлениях. Благодаря вытянутой форме гибридных орбиталей достигается более полное перекрывание взаимодействующих электронных облаков, а значит, образуются более прочные химические связи. Энергия, выделяющаяся при образовании этих связей, больше, чем суммарные затраты энергии на возбуждение атома бериллия и гибридизацию его атомных орбиталей. Поэтому процесс образования молекулы BeF2 энергетически выгоден.
В целях упрощения рисунка гибридные sp-электронные облака атома бериллия изображены неполностью.
Рассмотренный случай гибридизации одной s- и одной р-орбитали, приводящий к образованию двух sp-орбиталей, называется sp-гибридизацией. Как показано на рис. 8, sp-орбитали ориентированы в противоположных направлениях, что приводит к линейному строению молекулы. Действительно, молекула BeF2 линейна, а обе связи Be—F в этой молекуле во всех отношениях равноценны.
Возможны и другие случаи гибридизации атомных орбиталей, однако число образующихся гибридных орбиталей всегда равно общему числу исходных атомных орбиталей, участвующих в гибридизации. Так, при гибридизации одной s- и двух р-орбиталей (sp2-гибридизация — читается «эс-пэ-два») образуются три равноценных sp2-орбитали. В этом случае гибридные электрон-
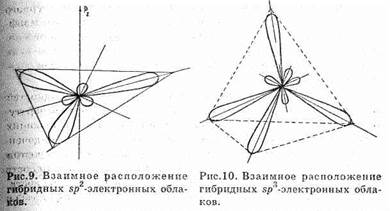
вые. облака располагаются в направлениях, лежащих в одной плоскости и ориентированных под углом 120° друг к другу (рис. .9), Очевидно, что этому типу гибридизации соответствует образование плоской треугольной молекулы.
, Примером молекулы, в которой осуществляется sp2-гибридизация, может служить молекула фторида бора BF3. Здесь вместо исходной одной s- и двух р-орбиталей возбужденного атома бора образуются три равноценные sp2-орбитали.
Поэтому молекула BF3 построена в форме правильного треугольника, в центре которого расположен атом бора, а в вершинах — атомы фтора. Все три связи В—F в молекуле BF3 равноценны.
Если в гибридизации участвуют одна s- и три р-орбитали (sp3-гибридизация), то в результате образуются четыре гибридные sp3-орбитали, вытянутые в направлениях к вершинам тетраэдра, т.е. ориентированные под углом 109°28' друг к другу (рис. 10). Такая гибридизация осуществляется, например, в возбужденном атоме углерода при образовании молекулы метана СН4:

Поэтому молекула метана имеет форму тетраэдра, причем все четыре связи C—Н в этой молекуле равноценны. Вернемся к рассмотрению структуры молекулы воды. При ее образовании происходит sp3-гибридизация атомных орбиталей
кислорода. Именно поэтому валентный угол НОН в молекуле Н2O (104,3°) близок не к 90°, а к тетраэдрическому углу (109,5°). Небольшое отличие этого угла от 109,5° можно понять, если принять во внимание неравноценность состояния электронных облаков, окружающих атом кислорода в молекуле воды. В самом деле, в молекуле метана (I):
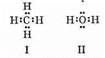
все восемь электронов, занимающие в атоме углерода гибридные sp3-орбитали, участвуют в образовании ковалентных связей С—Н. Это обуславливает симметричное распределение электронных облаков по отношению к ядру атома углерода. Между тем в молекуле воды (II) только четыре из восьми электронов, занимающих гибридные sp3-орбитали атома кислорода, образуют связи О—Н, а две электронные пары остаются неподеленными, т.е. принадлежат только атому кислорода. Это приводит к некоторой асимметрии в распределении электронных облаков, окружающих атом кислорода, и, как следствие, к отклонению угла между связями О—Н от 109,5°.
При образовании молекулы аммиака также происходит sp3 -гибридизация атомных орбиталей центрального атома (азота). Именно поэтому валентный угол HNH (107,8°) близок к тетраэдрическому. Небольшое отличие этого угла от 109,5° объясняется, как и в молекуле воды, асимметрией в распределении электронных облаков вокруг ядра атома азота: из четырех электронных пар три участвуют в образовании связей N—Н, а одна остается неподеленной.
У элементов третьего и последующих периодов в образовании гибридных электронных облаков могут участвовать и d-орбитали. Особенно важен случай sp3d2-гибридизации, когда в образовании гибридных орбиталей участвуют одна s-, три р- и две d-орбитали. В этом случае образуется шесть равноценных гибридных орбиталей, вытянутых в направлениях к вершинам октаэдра. Октаэдрическая структура молекулы SF6 ионов [SiF6]2-, [Fe(CN6)]3-и многих других объясняется sp3d2-гибридизацией атомных орбиталей центрального атома.
6.3.8. Молекулярные орбитали
До сих пор образование химических связей рассматривалось как результат обобществления одной или нескольких пар элек-
тронов на перекрывающихся орбиталях каждых двух соседних атомов в молекулах. Однако нередки случаи, когда выбор валентных схем, описывающих образование связей, неоднозначен, потому что связи не локализованы между теми или иными соседними атомами, а, наоборот, могут быть делокализованы вдоль всей молекулы (как, например, p-связи в бутадиене или в бензоле). Представление о делокализации лежит в основе особого подхода к описанию химической связи в молекулах, который называется методом молекулярных орбиталей и отличается от применявшегося ранее метода, называемого методом валентных схем. Во многих случаях метод молекулярных орбиталей (ММО) приводит к более правильному описанию характера связи и свойств молекул.
Основное предположение метода МО заключается в том, что в молекуле каждый валентный электрон движется по орбитали, которая в большей или меньшей мере простирается на всю молекулу и называется поэтому молекулярной орбиталью.
Подобно атомным орбиталям, молекулярные орбитали представляют собой области пространства, доступные для движения электронов; как и в случае атомов, молекулярные орбитали обозначают в соответствии с их энергией и пространственным распределением (разумеется, при этом используются специфические обозначения). Вообще говоря, представление о молекулярных орбиталях является обобщением представления об атомных орбиталях.
Из-за сложной формы молекул (по сравнению с шаровой формой атомов) найти математические выражения для описания молекулярных орбиталей оказывается намного сложнее, чем для атомных орбиталей.
Это заключается в сложении или вычитании с подходящими коэффициентами математических выражений для атомных орбиталей, относящихся к различным атомам молекулы. Такая математическая операция равнозначна предположению, что, двигаясь в пределах молекулярной орбитали вдоль всей молекулы, электрон поочередно оказывается у каждого из атомов и, следовательно, в этот момент находится на его атомной орбитали. Например, две самые низкие по энергии молекулярные орбитали H2 могут быть приближенно определены сложением и вычитанием наиболее низких по энергии атомных орбиталей двух атомов водорода — 1sA — орбитали атома НA и 1sB — орбитали атома НB. Если атомы НA и НB расположены достаточно близко друг от друга, чтобы между их 1s-орбиталями происходило заметное Перекрывание, то сложение этих атомных орбиталей (речь идет об описывающих их математических функциях) приводит к образо-
ванию молекулярной орбитали, локализованной главным образом в пространстве между ядрами атомов, т.е. в связывающей орбитали из другой (опять-таки имеются в виду математические функции, описывающие эти орбитали) приводит к образованию молекулярной орбитали, локализованной, наоборот, главным образом по обе стороны от ядер, т.е. в разрыхляющей области молекулы.
Двигаясь по первой из этих молекулярных орбиталей, электрон будет в основном связывать ядра молекулы, а оказавшись на второй молекулярной орбитали, электрон будет в основном отрывать ядра друг от друга (разрыхлять связь). Поэтому молекулярная орбиталь, полученная сложением атомных орбиталей, называется связывающей (обозначается: s1s-орбиталь), а подученная их вычитанием — разрыхляющей молекулярной орбиталью,(обозначается s*1s-орбиталь). На рис. 11 показано распределение электронной плотности, другими словами, вероятность обнаружить электрон в различных точках вдоль межъядерной оси молекулы водорода, для связывающей и разрыхляющей молекулярных орбиталей. На этом же рисунке изображена диаграмма энергетических уровней молекулярных орбиталей. Ясно, что энергия молекулы с электроном на связывающей орбитали должна быть ниже, чем у двух исходных атомов, находящихся на большом расстоянии друг от друга, а энергия молекулы с электроном на разрыхляющей орбитали, наоборот, выше, чем у двух изолированных атомов. Поэтому уровень s1s на энергетической диаграмме молекулы Н2 расположен ниже атомных уровней 1s, a уровень s*1s, наоборот, выше их.
Рассмотренный простейший пример приближенного построения молекулярных орбиталей из орбиталей атомов, составляющих молекулу, позволяет понять общие черты этого метода, суть которого сводится к следующему. Степень понижения энергетического уровня связывающей молекулярной орбитали по сравнению с энергетическими уровнями исходных атомов орбиталей и повышения уровня разрыхляющей молекулярной орбитали зависит от энергии исходных атомных орбиталей и от эффективности их перекрывания между собой. Число молекулярных орбиталей, которые можно получить путем составления линейных комбинаций атомных орбиталей, всегда равно числу исходных атомных орбиталей.
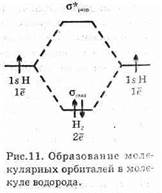
Молекулярные орбитали заполняются электронами в соответствии с теми же правилами, что и атомы. В наиболее устойчивом состоянии молекулы электроны заполняют по возможности наиболее низкие молекулярные орбитали, при этом согласно принципу Паули на каждой из них может одновременно находиться не более двух электронов. Поэтому два электрона в молекуле водорода занимают связывающую s1s-орбиталь, а разрыхляющая s*1s-орбиталь в основном (возбужденном) состоявши молекулы остается незаполненной.
Записывая распределение электронов по молекулярным орбиталям, принято указывать электронные конфигурации молекул, подобно тому как это делается в случае атомов. Например, электронное строение молекулы водорода условно изображается конфигурацией (s1s)2. Эта молекула содержит два связывающих электрона.
Если бы существовала двухатомная молекула гелия, то, расположив имеющиеся в ней четыре электрона по наиболее низким молекулярным орбиталям, мы должны были получить с учетом принципа Паули конфигурацию (s1s)2(s*1s)2. Такая молекула содержала бы, Следовательно, два связывающих и два разрыхляющих электрона. Если предположить, что разрыхляющие электроны на s*-орбитали в точности компенсируют связывающее действие электронов на s-орбитали, то порядок связи в молекуле гелия должен быть равен нулю; это предсказание неустойчивости молекулы Не2 действительно подтверждается.
Вспомним!
Приведенные рассуждения позволяют понять, почему не существует двухатомной молекулы гелия Не2. В связывающем пространстве такой молекулы одновременно смогли бы находиться только два из четырёх электронов, имеющихся у двух атомов гелия. Двум оставшимся электронам, подчиняясь принципу Паули, пришлось бы двигаться в разрыхляющих областях молекулы, и их присутствие приводило бы к ослаблению связи. И действительно, влияние двух связывающих и двух разрыхляющих электронов настолько компенсируется, что при сближении двух атомов гелия образуется крайне неустойчивая молекула Не.. .Не с энергией связи всего 0,05 кДж/моль и очень большим расстоянием между ядрами (0,292 нм по сравнению с 0,074 нм в молекуле H2). Однако, если удалить один электрон, действие двух связывающих электронов в этом случае становится настолько сильнее противодействия одного разрыхляющего электрона, что молекулярный ион Не+2 оказывается вполне устойчивой частицей с энергией связи примерно равной -210 кДж/моль и расстоянием между ядрами 0,108 нм.
Из всего сказанного можно сделать следующие выводы.
Образование химической связи между атомами обусловлено тем, что при их сближении электроны получают возможность двигаться вблизи двух или нескольких ядер, одновременно притягиваясь к ним; химическая связь возникает в результате обобществления электронов соседними атомами. Обобществление электронов приводит к связыванию атомов в молекулу в том случае, когда оно происходит в связывающем пространстве, между ядрами; обобществление электронов в разрыхляющем пространстве, по обе стороны от ядер, наоборот, ослабляет химическую связь. В простейшем случае химическая связь возникает при сближении двух атомов, у каждого из которых имеется по одному неспаренному электрону на полузаполненной атомной орбитали. При перекрывании двух таких орбиталей на каждой из них одновременно может оказаться не более двух электронов; это не запрещено принципом Паули при условии, что электроны имеют противоположные спины.
В дальнейшем мы убедимся, что в зависимости от природы соединяющихся атомов обобществленные ими электроны могут распределяться между атомами более или менее равномерно. Химическая связь, при которой обобществленные электроны равномерно распределены между связывающимися атомами, называется ковалентной связью.
В рамках теории молекулярных орбиталей порядок связи (порядком связи называется число электронных пар, приходящихся на каждую связь в молекуле) определяется как половина разности числа связывающих и разрыхляющих электронов на молекулярных орбиталях, относящихся к данной связи (это определение не вызывает никаких осложнений в случае двухатомных молекул).
Для молекул водорода или гелия метод молекулярных орбиталей не дает ничего нового по сравнению с тем, что известно на основании подробного рассмотрения связывающих и разрыхляющих областей молекул (см. «Ковалентная связь»), В самом деле, при этом просто применяют другой, более удобный язык для описания тех же явлений. Однако язык МО позволяет без особых осложнений перейти к анализу многоэлектронных молекул, где дело обстоит не так просто, если пользоваться методом валентных схем (ВС), и где метод МО позволяет правильнее описывать химическую связь и свойства молекул.
Для описания электронного строения двухатомных молекул с большим числом электронов, чем в случае водорода или гелия, например молекулы кислорода, необходимо сконструировать молекулярные орбитали не только из 1s-орбиталей атомов кислорода, но также из 2s- и 2р-орбиталей, занятых электронами, а в более
сложных случаях приходится принять во внимание и другие атомные орбитали.
Из двух 2s-орбиталей можно построить две молекулярные орбитали наподобие того, как это было сделано в случае 1s-орбиталей; в результате получается s2s- и s*2s-молекулярные орбитали. Комбинируя три 2p-орбитали на одном атоме с тремя 2p-орбиталями на другом атоме двухатомной молекулы, можно получить еще шесть молекулярных орбиталей. Если при выборе системы координат совместить ось X с межъядерной осью молекулы, то комбинация двух px-орбиталей даст связывающую и разрыхляющую молекулярные орбитали (s2рх и s*2рх) соответственно, которые вытянуты вдоль межъядерной оси (орбиталь s2рх локализована главным образом в межъядерном пространстве, а орбиталь s*2рх, наоборот, по обе стороны от ядер).
Комбинация py-орбиталей двух атомов приведет к образованию связывающей и разрыхляющей p2py и p*2py орбиталей, пучности которых расположены по обе стороны от межъядерной оси; эти орбитали возникают в результате бокового перекрывания двух py-орбиталей, ориентированных перпендикулярно межъядерной оси. Из pz-орбиталей двух атомов также образуются две p-орбитали (p2pz- и p*2pz-), но их пучности, расположенные по обе стороны межъядерной оси, ориентированы под углом 90° к пучностям p2ру-и p*2y-орбиталей. Энергии p2ру- и p2рz-орбиталей (как и энергии составляющих их 2ру- и 2рz-орбиталей) одинаковы; это же относится и к энергиям разрыхляющихp*2ру- и p*2рz-орбиталей.
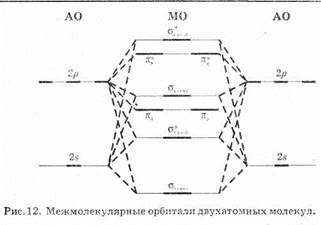
На рис. 12 показаны относительные энергии и форма десяти первых (считая в порядке повышения энергетических уровней) молекулярных орбиталей для гомоядерной двухатомной молекулы (такая диаграмма получается для двухатомных молекул Li2, Ве2, В2, С2 и N2; для молекул O2, F2 и Ne2 соответствующая диаграмма отличается только противоположным порядком следования уровней молекулярных орбиталей s2р и p2р). Молекулярные орбитали с более высокими энергиями могут быть получены путем комбинации 3s-, Зр- и еще более высоких атомных орбиталей. Однако тех молекулярных орбиталей, которые показаны на рис. 12, вполне достаточно для описания химической связи в двухатомных молекулах, содержащих до 20 электронов.
Пользуясь диаграммой энергетических уровней на рис. 12, нетрудно видеть, что молекула азота N2, в которой имеется 14 электронов, может быть описана электронной конфигурацией:
N2: (s1s)2(s*1s)2(s2s)2(s2s)2(p2py)2(p2pz)2(si2px)2
Поскольку в этом случае имеются 10 связывающих и 4 разрыхляющих электрона, порядок связи в молекуле должен быть
равен (10 - 4):2 = 3, что совпадает с выводом о наличии тройной связи в молекуле азота, к которому приводит метод ВС.
Электронная конфигурация молекулы кислорода с 16 электронами на основании соответствующей ей диаграммы энергетических уровней (рис. 12), должна иметь такой вид:
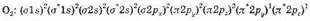
Напомним, что при наличии нескольких эквивалентных по энергии орбиталей электроны распределяются по ним в соответствии с правилом Гунда так, чтобы занять как/можно большее число орбиталей, поэтому в случае молекулы кислорода молекулярные орбитали p*2ру и p*2pz должны быть полузаполненными. Эта особенность электронной конфигурации молекулы кислорода позволяет сделать предположение, что молекула должна обладать двумя электронами с неспаренными спинами, а следовательно, кислород должен намагничиваться в магнитном поле. Такой вывод подтверждается опытом по намагничиванию жидкого кислорода, хотя и не соответствует выводу теории ВС, согласно которой химическая связь в молекуле кислорода осуществляется двумя парами спаренных электронов со взаимно скомпенсированными спинами (скомпенсированными магнитными полями).
Предсказание наличия магнитных свойств у молекулы кислорода является одним из первых триумфов теории МО. Порядок связи в молекуле кислорода согласно обеим теориям равен 2.
Молекулярный ион кислорода О+2 имеет на один электрон меньше, чем молекула О2, и, следовательно, должен иметь только один электрон на p-орбитали. Порядок связи в этой частице равен (10 - 5):2 = 2,5. С другой стороны, надперекисный ион O-2 имеет
а один электрон больше, чем молекула О2, и так как этот электрон попадает тоже на p*-орбиталь, порядок связи в нем оказывается равным (10 - 7):2 = 1,5. Перекисный же ион O2-2, имеющий 18 электронов, обладает полностью заполненной p* -оболочкой и, следовательно, имеет порядок связи 1. Таким образом, теория молекулярных орбиталей вполне объясняет существование дробных порядков связи. Опытные данные показывают, что длина связи в O+2, O2, O-2и O2-2 равна соответственно 0,117 нм, 0,121 нм, 0,128 нм и 0,149 нм в согласии с общей закономерностью изменения порядков и длин связей.
Двухатомная молекула фтора F2 изоэлектронна (имеет одинаковое число электронов) с перекисным ионом О2-2 и, следовательно, тоже имеет порядок связи, равный 1. Два дополнительных электрона, необходимых для построения молекулы Ne2, должны были бы занимать s*2р-орбиталь, что дало бы порядок связи, равный нулю. И действительно, такая молекула неизвестна.
Рассмотрим зависимость порядков связи, а также длин связи и энергии связи от числа валентных электронов в двухатомных молекулах элементов II периода. По мере увеличения числа электронов в этих молекулах порядок связи сначала постепенно нарастает, принимая максимальное значение у азота, после чего убывает до нуля у неона. В соответствии с этим происходит постепенное увеличение энергии связи от азота к неону и, наоборот, уменьшение длины связи от бора до азота, после чего все величины начинают изменяться в обратном порядке. Теория молекулярных орбиталей позволяет последовательно объяснить все эти закономерности путем рассмотрения электронных конфигураций молекул.
Диаграмма энергетических уровней молекулярных орбиталей гомоядерных двухатомных молекул, изображенная на рис. 12, может быть также использована для описания электронных конфигураций простых гетероядерных молекул или ионов. Например, молекула оксида азота (II) изоэлектронна с ионом О+2 и, следовательно, должна иметь порядок связи 2,5. Этот вывод согласуется с опытными данными, согласно которым длина связи в молекуле NO, равная 0,115 нм, имеет промежуточное значение между длиной связи 0,110 нм в молекуле N2 с порядком связи 3 и
0,121 нм в молекуле O2 с порядком связи 2.
Метод составления линейных комбинаций атомных орбиталей приближенного определения молекулярных орбиталей
годен и для нахождения молекулярных орбиталей многоатомных молекул, однако практически эта процедура сталкивается с большими вычислительными трудностями.
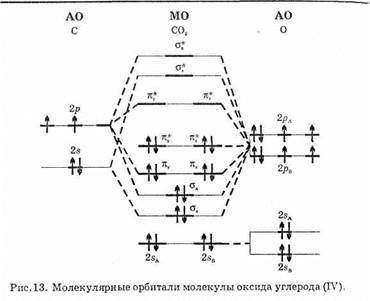
молекулярных орбиталей, на которых размещаются валентные электроны молекулы СО2; там же указана приблизительная картина распределения электронной плотности для различных молекулярных орбиталей этой молекулы (форма ее молекулярных орбиталей). Определение порядка связей для многоатомных молекул на основании теории молекулярных орбиталей осуществляется не так просто, как для двухатомных молекул. Однако само определение понятия порядка связи остается прежним:

Вместе с тем следует принять во внимание, что в многоатомных молекулах, помимо связывающих и разрыхляющих электронов, часто встречаются еще и несвязывающие электроны, существенно локализованные на одном из атомов и не дающие никакого положительного либо отрицательного вклада в связывание между атомами. (Например, некоторые из указанных на рис. 13 молекулярных орбиталей явно локализованы на исходных атомах и поэтому являются несвязывающими; такие орбитали обычно обозначают символом n). Другая трудность заключается в том, что не всегда ясно, как быть при разделении общего порядка связи в многоатомной молекуле на соответствующее число связей.
Дата добавления: 2016-01-03; просмотров: 9012;
