Механизмы образования ковалентной связи: обменный и донорно-акцепторный
Химическая связь. Типы химической связи: ковалентная, ионная, металлическая, водородная
Химическая связь
Учение о химической связи — центральный вопрос современной химии. Без него нельзя понять причины многообразия химических соединений, механизмы их образования, строения и реакционной способности.
Большинство встречающихся в природе и получаемых искусственно веществ в обычных условиях не содержат индивидуальных атомов в химически несвязанном состоянии. Исключение составляют лишь благородные газы. В остальных веществах атомы входят в состав молекул этих веществ или образуют кристаллическую решетку. Именно возможность атомов связываться друг с другом обуславливает такое широкое многообразие химических веществ при относительно небольшом числе составляющих их химических элементов.
Причины образования химической связи между атомами можно искать в электростатической природе самого атома. Благодаря наличию в атомах пространственно разделенных областей, обладающих электрическим зарядом, между различными атомами могут возникать электростатические взаимодействия, способные удерживать эти атомы вместе.
При образовании химической связи происходит перераспределение в пространстве электронных плотностей, исходно относившихся к различным атомам. Поскольку наименее прочно связаны с ядром электроны внешнего уровня, то в образовании химической связи именно этим электронам принадлежит главная роль. Количество химических связей, образованных данным атомом в соединении, называют валентностью. По этой причине электроны внешнего уровня называют валентными электронами.
С энергетической точки зрения наиболее устойчивым оказывается атом, обладающий завершенным внешним уровнем (чем больше электронов на этом уровне, тем сильнее они связаны с ядром, вспомните закон Кулона). Поэтому благородные газы при обычных условиях находятся в состоянии химически инертного
одноатомного газа. По этой же причине атомы, обладающие не полностью завершенным внешним уровнем, стремятся к его завершению. Эта закономерность положена в основу теории образования химической связи в форме положения, сформулированного В. Косселем и Г. Льюисом:

С точки зрения современной теории химической связи, возможно несколько способов образования энергетически устойчивой электронной конфигурации. Эти способы приводят к образованию структур различного строения. Соответственно различают ковалентную (обменную и донорно-акцепторную) и ионную связь. Далее мы рассмотрим каждый из указанных типов связи отдельно.
Механизмы образования ковалентной связи: обменный и донорно-акцепторный
Известно, что неметаллы взаимодействуют друг с другом. Рассмотрим механизм возникновения ковалентной связи на примере образования молекулы водорода:
Н+Н=Н2 DH=-436кДж/моль
Представим себе, что мы имеем два отдельных изолированных атома водорода. Ядро каждого из свободных атомов водорода окружено сферическим симметричным электронным облаком, образуемым 1s-электроном (см. рис. 5). При сближении атомов до
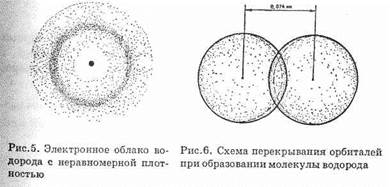
определенного расстояния происходит частичное перекрывание электронных оболочек (орбиталей) (рис. 6).
В результате между центрами обоих ядер возникает молекулярное двухэлектронное облако, обладающее максимальной электронной плотностью в пространстве между ядрами; увеличение плотности отрицательного заряд» благоприятствует сильному возрастанию сил притяжения между ядрами и молекулярным облаком.
Итак, ковалентная связь образуется в результате перекрывания электронных облаков атомов, сопровождающегося выделением энергии. Если у сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм, то после перекрывания электронных облаков (образования молекулы H2) это расстояние составляет 0,074 нм (рис. 6). Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов. Химическая связь тем прочнее, чем больше перекрывание электронных орбиталей. В результате возникновения химической связи между двумя атомами водорода каждый из них достигает электронной конфигурации атома благородного газа.
Изображать химические связи принято по-разному:
1) с помощью электронов в виде точек, поставленных у химического знака элемента. Тогда образование молекулы водорода можно показать схемой:
Н•+•Н®Н:Н
2) с помощью квантовых ячеек (ячеек Гунда), как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке:

Схема, расположенная слева, показывает, что молекулярный энергетический уровень ниже исходных атомных уровней, а значит, молекулярное состояние вещества более устойчиво, чем атомное.
3) часто, особенно в органической химии, ковалентную связь изображают черточкой (штрихом) (например Н—Н), которая символизирует пару электронов.
Ковалентная связь в молекуле хлора также осуществляется с помощью двух общих электронов, или электронной пары:
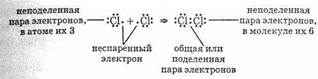
Как видно, каждый атом хлора имеет три неподеленные пары и один неспаренный электрон. Образование химической связи происходит за счет неспаренных электронов каждого атома. Неспаренные электроны связываются в общую пару электронов, называемую также поделенной парой.
Если между атомами возникла одна ковалентная связь (одна общая электронная пара), то она называется одинарной; если больше, то кратной (две общие электронные пары), тройной (три общие электронные пары).
Одинарная связь изображается одной черточкой (штрихом), двойная — двумя, тройная — тремя. Черточка между двумя атомами показывает, что у них пара электронов обобщена, в результате чего и образовалась химическая связь. С помощью таких черточек изображают последовательность соединения атомов в молекуле (см. §3).
Итак, в молекуле хлора каждый его атом имеет завершенный внешний уровень из восьми электронов (s2p6), причем два из них (электронная пара) в одинаковой мере принадлежат обоим атомам.
Несколько по-иному изображают связь в молекуле кислорода О2. Экспериментально установлено, что кислород является парамагнитным веществом (втягивается в магнитное поле). В его молекуле имеется два неспаренных электрона. Структуру этой молекулы можно изобразить так:
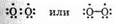
Однозначное решение об изображении электронной структуры молекулы кислорода еще не найдено. Однако ее нельзя изображать так:
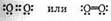
В молекуле азота N2 атомы имеют три общие электронные пары:
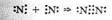
Очевидно, что молекула азота прочнее молекулы кислорода или хлора, чем и обусловлена значительная инертность азота в химических реакциях.
Химическая связь, осуществляемая электронными парами, называется ковалентной . Это двухэлектронная и двухцентровая (удерживает два ядра) связь. Соединения с ковалентной связью называются гомеополярными, или атомными.
Различают две разновидности ковалентной связи: неполярную и полярную. ,
В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов, или электронное облако связи, распределяется в пространстве симметрично относительно ядер обоих атомов. Примером являются двухатомные молекулы, состоящие из атомов одного элемента: Н2 Cl2, О2, N2, F2 и др.. в которых электронная пара в одинаковой мере принадлежит обоим атомам.
В случае полярной ковалентной связи электронное облако связи смещено к атому с большей относительной электроотрицательностью (см. §6.3.4). Примером могут служить молекулы летучих неорганических соединений: НС1, Н2О, H2S, NH3 и др.
Образование молекулы НС1 можно представить схемой:
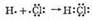
Электронная пара смещена к атому хлора, так как относительная электроотрицательность атома хлора (2,83) больше, чем атома водорода (2,1).
Ковалентная связь образуется не только за счет перекрывания одноэлектронных облаков, — это обменный механизм образования ковалентной связи.
Возможен и другой механизм образования ковалентной связи — донорно-акцепторный. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого атома. Рассмотрим в качестве примера механизм образования иона аммония NH+4. В молекуле аммиака атом азота имеет неподеленную пару электронов (двухэлектрон-
ное облако):
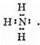
У иона водорода свободна (не заполнена) 1s-
орбиталь, что можно обозначить так: Н+. При образовании иона аммония двухэлектронное облако азота становится общим для атомов азота и водорода, т.е. оно превращается в молекулярное электронное облако. А значит, возникает четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой:
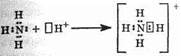
Заряд иона водорода становится общим (он делокализован, т.е. рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежащее азоту, становится общим с водородом. В схемах изображение ячейки часто опускается.
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (т.е. предоставляющий свободную орбиталь), называется акцептором.

Однако это не особый вид связи, а лишь иной механизм (способ) образования ковалентной связи. По свойствам четвертая N-H-связь в ионе аммония ничем не отличается от остальных связей,
Металлическая связь
Атомы большинства металлов на внешнем энергетическом уровне содержат небольшое число электронов. Так, по одному электрону содержат 16 элементов, по два — 58, по три — 4 элемента и ни одного — только у Pd. Атомы элементов Ge, Sn и Pb имеют на внешнем уровне по 4 электрона, Sb и Bi — по 5, Ро — 6, но эти элементы не являются характерными металлами.
Элементы металлы образуют простые вещества — металлы. В обычных условиях это кристаллические вещества (кроме ртути). На рис. 7 представлена схема кристаллической решетки натрия. Как видно, каждый атом натрия окружен восемью соседними. На примере натрия рассмотрим природу химической связи в металлах.
У атома натрия, как и у других металлов, имеется избыток валентных орбиталей и недостаток электронов. Так, валентный электрон (3s1) может занимать одну из девяти свободных орбиталей — 3s (одна), Зр (три) и 3d (пять). При сближении атомов в результате образо-
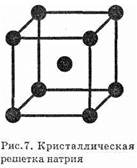
вания кристаллической решетки валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются из одной орбитали в другую, осуществляя связь между всеми атомами кристалла металла. Такой тип химической связи называется металлической связью.
Металлическую связь образуют элементы, атомы которых на внешнем уровне имеют мало валентных электронов по сравнению с общим числом внешних энергетически близких орбиталей, а валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме. Химическая связь в металлических кристаллах сильно делокализована, т.е. электроны, осуществляющие связь, обобществлены («электронный газ») и перемещаются по всему куску металла, в целом электронейтрального.
Металлическая связь характерна для металлов в твердом и жидком состоянии. Это свойство агрегатов атомов, расположенных в непосредственной близости друг к другу. Однако в парообразном состоянии атомы металлов, как и всех веществ, связаны между собой ковалентной связью. Пары металлов состоят из отдельных молекул (одноатомных и двухатомных). Прочность связи в кристалле больше, чем в молекуле металла, а потому процесс образования металлического кристалла протекает с выделением энергии.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку и в ее основе лежит обобществление валентных электронов. Однако электроны, которые осуществляют ковалентную связь, находятся вблизи соединенных атомов и прочно с ними связаны. Электроны же, осуществляющие металлическую связь, свободно перемещаются по всему кристаллу и принадлежат всем его атомам. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической — пластичны, т.е. они изменяют форму при ударе, прокатываются в тонкие листы и вытягиваются в проволоку.
Металлической связью объясняются физические свойства металлов.
Водородная связь
Водородная связь — это своеобразная химическая связь. Она может быть межмолекулярной и внутримолекулярной.
Межмолекулярная водородная связь возникает между молекулами, в состав которых входят водород и сильно электроотрицательный элемент — фтор, кислород, азот, реже хлор, сера. Поскольку в такой молекуле общая электронная пара сильно смещена от водорода к атому электроотрицательного элемента, а
положительный заряд водорода сконцентрирован в малом объеме, то протон взаимодействует с неподеленной электронной парой другого атома или иона, обобществляя ее. В результате образуется вторая, более слабая связь, получившая название водородной.
Ранее водородную связь сводили к электростатическому притяжению между протоном и другой полярной группой. Но более правильным следует считать, что в ее образование вносит вклад и донорно-акцепторное взаимодействие. Для этой связи характерны направленность в пространстве и насыщаемость.
Обычно водородную связь обозначают точками и этим указывают, что она намного слабее ковалентной связи (примерно в 15-20 раз). Тем не менее она ответственна за ассоциацию молекул. Например, образование димеров (в жидком состоянии они наиболее устойчивы) воды и уксусной кислоты можно представить схемами:
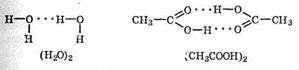
Как видно из этих примеров, посредством водородной связи объединены две молекулы воды, а в случае уксусной кислоты — две молекулы кислоты с образованием циклической структуры.
Водородная связь оказывает влияние на свойства многих веществ. Так, благодаря водородной связи фтороводород в обычных условиях существует в жидком состоянии (ниже 19,5 С) и содержит молекулы состава от H2F2 до H6F6. Благодаря водородной связи образуется гидродифторид-ион HF2-:
f-+ h—f®f-• • •h—f ® hf-2
который входит в состав солей — гидрофторидов (KHF2 — гидродифторид калия, NH4HF2 — гидродифторид аммония).
Наличием водородных связей объясняется более высокая температура кипения воды (100° С) по сравнению с водородными соединениями элементов подгруппы кислорода (H2S, H2Se, Н2Те). В случае воды надо затратить дополнительную энергию на разрушение водородных связей.
Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединений, а потому эти связи играют важную роль в химии процессов жизнедеятельности.
Дата добавления: 2016-01-03; просмотров: 6973;
