Валентность и ионизационный потенциал
Основным фактором, определяющим химические реакции между элементами и составы соединений, является их валентность. Число валентных электронов и их квантовое состояние во взаимодействующих металлах играет важную роль в установлении предельных концентраций твердых растворов и составов металлических соединений. Валентность элементов находится в зависимости от их положения в периодической системе. Наиболее электроположительные металлы (I группа) имеют по одному внешнему электрону; число внешних электронов возрастает по мере увеличения номера группы для металлов до шести, для металлоидов – до семи. Наиболее простыми являются взаимоотношения между элементами с одинаковой валентностью, расположенными в одной группе. Взаимоотношения между элементами становятся более сложными по мере увеличения разницы количества внешних электронов в атомах металлов и метллоидов.
Сила связи электронов в атомах определяется ионизационным потенциалом, мерой которого является энергия, необходимая для удаления внешних электронов из атома. Потенциал ионизации первого порядка характеризует энергию отделения первого валентного электрона; второго порядка – отделение второго электрона из иона после удаления первого электрона.
Ионизационный потенциал характеризует легкость отдачи электрона атомом и, следовательно, может служить количественной характеристикой металлических свойств атома. В химических реакциях металлы с меньшим значением потенциала ионизации отдают внешние электронам неметаллам с большим значением потенциалов ионизации.
На рис. 2 приведены значения ионизационных потенциалов первого порядка элементов периодической системы. Как это видно из рисунка, наиболее электроположительные металлы I группы имеют наименьшее значение ионизационного потенциала, которое постепенно возрастает по мере увеличения номера группы. Характерным является также, что металлы переходных групп, независимо от числа внешних электронов по группам периодической системы, мало отличаются друг от друга по значениям ионизационных потенциалов. Это обстоятельство играет важную роль в образовании широкого класса твердых растворов на основе этих металлов и в меньшей их склонности к образованию соединений между собой.
Максимальные значения ионизационного потенциала соответствуют элементам нулевой группы с полным заполнением электронных орбит. По группам, за некоторым исключением, это свойство уменьшается по мере увеличения атомного номера элемента данной группы. Металлические элементы отличаются от металлоидов меньшими значениями потенциалов ионизации, как это особенно заметно для элементов одной и той же группы.
Наименьшее значение ионизационного потенциала имеют наиболее электроположительные металлы I группы периодической системы. По мере увеличения номера группы значение ионизационного потенциала элемента постепенно возрастает. Металлы переходных групп, независимо от числа внешних электронов по группам периодической системы, мало отличаются друг от друга по значениям ионизационных потенциалов. На их основе образуется широкий класс твердых растворов, у них меньше склонность к образованию соединений между собой.
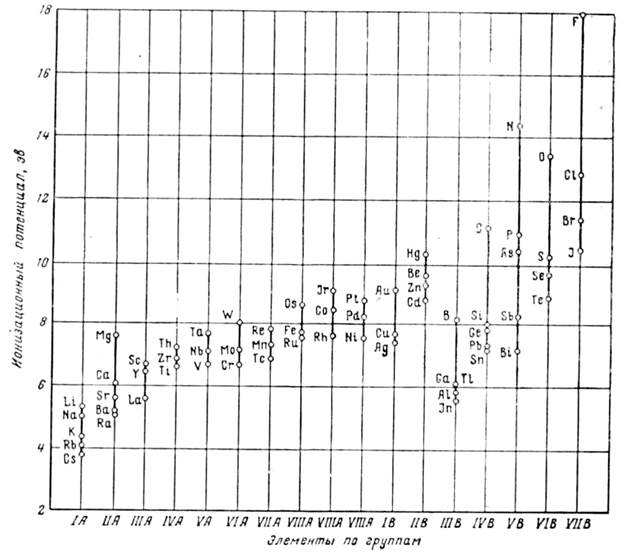
Рис. 2. Ионизационный потенциал (первый) элементов
по группампериодической системы
Электроположительные металлические элементы при обычных химических реакциях склонны легко отдавать внешние электроны, а электроотрицательные — металлоиды с большими ионизационными потенциалами — принимать электроны. Эти в различной степени проявляемые донорные и акцепторные свойства металлов и металлоидов имеют важное значение в образовании различного рода соединений металлов с широким диапазоном изменения химической связи.
МЕЖАТОМНАЯ СВЯЗЬ. КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА
И ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ И СПЛАВОВ
Межатомная связь
Главным фактором, определяющим кристаллическую структуру и физические свойства металлов и сплавов, является природа межатомной связи. Характер и сила межатомной связи в металлах и металлических фазах определяются энергетическим состоянием электронов в кристаллической решетке.
Электроны могут в различной степени переходить от одного атома к другому. В зависимости от степени перехода различают четыре типа межатомной связи:
- металлическую – проявляется при полном отрыве всех валентных электронов от атомов и равномерном распределении их в межионном пространстве;
- ионную – образуется при полном переходе валентных электронов от одного атома к другому;
- ковалентную, для которой характерно объединение электронов двух атомов в связывающие пары;
- связь Ван-дер-Ваальса – определяется наличием слабого смещения электронов, приводящим к появлению слабых полярных сил.
Если химическое соединение образуется только металлическими элементами, в этом случае имеет место металлическая связь. Такая связь не является жесткой. При определенных условиях возможно отклонение от стехиометрического соотношения элементов по формуле данного химического соединения.
При образовании химического соединения металла с неметаллом имеет место ионная связь. В соединениях такого типа связь жесткая и химический состав постоянный, точно соответствующий стехиометрическому соотношению элементов.
Четыре крайних типа межатомной связи редко встречаются в чистом виде. Во многих веществах, в том числе металлических сплавах и соединениях, связь является более сложной, смешанной, при этом один из типов связи проявляется в большей степени. Наиболее прочной является ковалентная связь, наименее прочной – вандерваальсовская.
В переходных металлах, металлических твердых растворах, соединениях, наряду с сильно выраженной металлической связью, проявляется также ковалентная связь, а иногда и ионная. Особенно проявляется ковалентная связь в металлических соединениях, многие из которых имеют высокие температуру плавления, электросопротивление и твердость. С повышением температуры у металлов, особенно имеющих полиморфные превращения, и у металлических соединений, очевидно, из-за разрушения ковалентных электронных «мостиков» тепловыми колебаниями атомов возрастает доля металлической связи, и они становятся более пластичными и электропроводными.
Межатомная связь осуществляется посредством электронов и приближенно оценивается такими физическими величинами, как ионизационный потенциал, температура плавления, температура рекристаллизации, характеристическая температура, температурный коэффициент линейного расширения, модуль упругости, предел прочности, энергия активации диффузии и самодиффузии, теплота сублимации и т.д. Связь считается тем прочнее, чем больше каждая из указанных величин, кроме коэффициента линейного расширения, который уменьшается с увеличением межатомной связи.
Дата добавления: 2016-02-04; просмотров: 1166;
