Стандартные потенциалы окислительно-восстановительных реакций. Ряд стандартных электродных потенциалов
Как вы уже знаете, химические процессы могут сопровождаться различными явлениями — поглощением и выделением теплоты, света, звука и т.д. В частности, они могут приводить к возникновению электрического тока или вызываться им. Такие процессы называются электрохимическими, и их открытие сыграло существенную роль как в химии, так и в физике.
Возьмем два одинаковых стакана. В один нальем раствор хлорида меди и опустим в него медную пластину, в другой — раствор хлорида цинка и опустим в него цинковую пластину. Внешне при этом в обоих стаканах ничего не происходит. Однако если соединить металлические пластины проводником с встроенным в него гальванометром и амперметром, то мы увидим, что стрелка гальванометра отклонится, показывая наличие разности потенциалов. При этом стрелка амперметра останется на нуле, что свидетельствует об отсутствии тока между пластинами. Что же происходит?
Хотя, опуская пластину меди в раствор соли меди, мы ничего не видели, кое-что все же происходило. В очень тонком (практически мономолекулярном) слое раствора, прилегающем к металлу, полярные молекулы воды начали вырывать из кристаллической решетки меди ее ионы:
Cu(тв)«Cu2++2e-
Этот процесс можно рассматривать как обычную химическую реакцию, но с участием необычного реагента — электронов, которые в результате реакции остаются в металле, придавая ему отрицательный заряд, Слой раствора, прилегающий к металлу, за счет избытка положительных ионов приобретает положительный заряд. Возникает разница потенциалов, которая стремится вернуть
ионы меди обратно в металл, и устанавливается равновесие. Получается, что в результате химического процесса появилось электрическое устройство — конденсатор (правда, имеющий молекулярные размеры). Он называется двойным электрическим слоем, а вся созданная система (металл — раствор его соли) — полуэлементом, В отличие от обычного химического равновесия, полученное нами характеризуется не только соотношением концентраций реагентов и продуктов, но и разницей потенциалов в двойном электрическом слое. Эта разница называется электродным потенциалом металла и характеризует окислительно-восстановительную способность твердого металла. (Сразу отметим, что такую способность для газообразного металла характеризует совсем другая величина — ионизационный потенциал, который равен энергии, необходимой для отрыва электрона от изолированного атома).
Непосредственно измерить электродный потенциал практически невозможно — ведь он существует между объектами, разделёнными одним слоем молекул. Однако если взять два полуэлемента, образованных разными металлами (как в нашем опыте), то потенциалы на металлических пластинах будут разными, что мы и заметили. Полученная система из двух полуэлементов называется гальваническим элементом.
••: Если мы соединим в нашем опыте стаканы трубочкой с раствором какой-либо соли (солевым мостиком), то амперметр покажет наличие тока. При этом, поскольку электродный потенциал цинка ниже, чем у меди, то электроны из цинковой пластины пойдут в медную. По принципу Ле Шателье в обоих полуэлементах сместится равновесие в двойном электрическом слое (ведь электроны участвуют в реакции!) Это приведет к тому, что медь из раствора будет осаждаться на медной пластине, а цинк уходить с цинковой пластины в раствор. По солевому мостику избыток положительных ионов из стакана с хлоридом цинка будет переходить в раствор хлорида меди, восстанавливая электростатическое равновесие. Этот процесс будет продолжаться до тех пор, пока либо не растворится полностью цинк, либо не кончится хлорид меди. Если отвлечься от электрических процессов и рассматривать только химические, то получится реакция: Cl2+Zn=Cu+ZnCl2
Но ее можно провести и без гальванического элемента! Однако только его участие объясняет, почему реакция идет именно в этом направлении, а, скажем, не наоборот. Таким образом, знание величин электродных потенциалов позволяет предсказать возмож-
ность и направление окислительно-восстановительных реакций. Как же их узнать?
Если использовать один и тот же полуэлемент (электрод сравнения) в сочетании с различными другими, то можно получить набор величин, которые будут отличаться от электродных потенциалов сравниваемых металлов на одну и ту же величину — на потенциал электрода сравнения. На практике эти величины можно использовать так же, как и сами электродные потенциалы.
Реально в качестве электрода сравнения используется водородный электрод. Он представляет собой специально подготовленную платиновую пластину, погруженную в раствор серной кислоты с концентрацией ионов водорода 1 моль/л и омываемую непрерывной струей водорода под давлением 100000 Па при температуре 25°С. При этом на поверхности платины происходят следующие процессы.
Н2«2Н (1)
Н«Н++e- (2)
Реакция (2), как видно, очень похожа на ту, что происходит в металлическом полуэлементе. На платиновой пластине появляется потенциал, который условно принят за ноль.
Если пластину металла, погруженного в раствор его соли с концентрацией 1 моль/л, соединить в гальванический элемент с водородным электродом при температуре 25°С, то возникшая разность потенциалов называется стандартным электродным потенциалом металла и обозначается как E°.
Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый электрохимический ряд напряжений металлов
Li, Rb, К, Ва, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
Если вспомнить, что происходило в нашем гальваническом элементе, то легко понять, почему расположение металлов в этом ряду предсказывает их свойства:
1) Каждый металл может вытеснять (восстанавливать) из растворов их солей те металлы, которые стоят в ряду напряжений после него.
2) Все металлы, имеющие отрицательный электродный потенциал (то есть стоящие в ряду напряжений до водорода), могут вытеснять (восстанавливать) его из растворов кислот.
Как нетрудно догадаться, понятие стандартного электродного потенциала приложимо не только к системе металл/ион металла, но и к любой реакции, проходящей с участием электронов. Эти реакции вам хорошо знакомы: вы их писали, составляя электронно-ионный баланс для уравнивания окислительно-восстановительных реакций, например:
Cr2O2-7+14Н++бe-®2Cr3++7Н2O
Мы не будем останавливаться на том, как измеряют стандартные электродные потенциалы таких полуреакций — это выходит за рамки данного курса, но такие методы есть, и с их помощью определены стандартные окислительно-восстановительные потенциалы огромного количества реакций. Они сведены в таблицы, где приводятся стандартные потенциалы реакций в форме:
| окисленная форма | + ne-® | восстановленная форма |
и, соответственно, показывают окислительную способность окисленной формы. Для того, чтобы понять, возможно ли протекание окислительно-восстановительной реакции, необходимо найти разность стандартных потенциалов соответствующих полуреакций. Например, узнаем, можно ли с помощью кислого раствора бихромата получить свободные галогены окислением бромидов и хлоридов. Находим в таблице 12 полуреакцию для окислителя
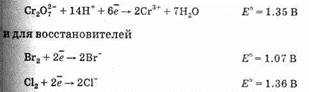
В случае бромида разница потенциалов 0.28 В > 0 и реакция K2Cr2O7+KBr+H2SO4 ®Cr2(SO4)3+K2SO4+H2O+Br2
будет идти. В случае же хлорида разница составляет -0.01 В<0 и аналогичная реакция происходить не будет. Напротив, будет идти обратная реакция, то есть окисление трехвалентного хрома в кислом растворе хлором. Однако нужно помнить, что выяснять направление реакции с помощью стандартных потенциалов можно только при условии, что реакция проходит при 25°С , а Концентрации всех реагентов — 1 моль/л. Так, на самом деле реакция окисления хлорида калия бихроматом калия будет идти, так как при 25°С невозможно создать в растворе концентрацию хлора 1 моль/л.


Дата добавления: 2016-01-03; просмотров: 2964;
