Электролиз растворов солей
Возьмем снова стакан, содержащий раствор хлорида меди с опущенной в него медной пластиной. Как вы помните, вокруг пластины существует равновесие
Cu(тв)«Cu2++2е-
Теперь возьмем источник постоянного тока и подсоединим его положительный полюс к пластине. Отрицательный подсоединим к другой медной пластине и опустим ее в тот же раствор. Таким образом, к одной пластине будут подаваться электроны, а от другой оттягиваться. По принципу Ле Шателье на обоих сместится равновесие, причем в разные стороны. С одной пластины медь будет переходить в раствор, а на другой, наоборот, осаждаться из раствора. Процесс будет продолжаться до тех пор, пока одна пластина полностью не растворится и вся медь с нее не перейдет на Другую. Мы провели процесс электролиза.

Действительно, на одном электроде происходило окисление
Cu(тв)-2e-=Cu2+ а на другом — восстановление меди
Cu2++2e-=Cu(тв)
В процессе электролиза электрод, соединенный с положительным полюсом источника тока, называется анодом. На нем происходит процесс окисления. Электрод, соединенный с отрицательным полюсом, называется катодом. На нем происходит восстановление.
А что будет происходить, если вместо медных электродов в нашем опыте мы возьмем инертные (например, из графита)? Около обоих электродов по-прежнему будет существовать равновесие (1). Однако, если на катоде мы по-прежнему можем его сместить (ведь в растворе есть ионы меди), то на аноде это невозможно — ведь металлической меди там нет. Цепь получается незамкнутой, однако электролиз все равно идет. Дело в том, что в растворе хлорида меди существует и другое равновесие,
2Сl- 2e-= Сl2
а оно будет смещаться как раз на аноде. Для соблюдения электростатического равновесия при образовании на катоде одного моля меди на аноде будет образовываться один моль хлора, а суммарно процесс электролиза будет отражен уравнением:
CuСl2=Cu+Сl2
Если вместо хлорида меди мы возьмем сульфат, то на аноде начнут окисляться гидроксид-ионы, которые всегда присутствуют в любом водном растворе: 4OH- - 4e-=2Н2O+O2
и электролиз все равно будет идти.
В растворе сульфата натрия уже и на катоде невозможно восстановление катионов натрия. Однако начнут восстанавливаться катионы водорода, которые тоже всегда есть в водном растворе. Тогда электродные процессы:
диссоциация воды: H2O«H++OH-
анод: 4OН- - 4е-=2Н2О+O2
катод: 2Н++2e-=Н2
а общий процесс сведется к электролизу воды:
2Н2O=2Н2+O2
Однако сульфат натрия там все же необходим, поскольку чистая вода не проводит электрического тока.
Суммируя, можно сказать, что в процессе электролиза раствора электролита на электродах всегда могут происходить следующие процессы:
1) На аноде
— окисление аниона, входящего в состав электролита;
— окисление гидроксид-ионов из воды до кислорода;
— растворение материала анода (если он не инертный)
2) На катоде
— восстановление катиона, входящего в состав электролита;
— восстановление катионов водорода из воды до водорода.
При этом из вышеперечисленных будет происходить та реакция, которая наиболее энергетически выгодна (она не обязательно будет одна). Для точного предсказания нужно знать все концентрации, температуру, напряжение источника и стандартные окислительно-восстановительные потенциалы для всех пар, находящихся в растворе. Однако в большинстве случаев можно руководствоваться простыми качественными правилами.
1. На инертном (платина, золото, графит) аноде при электролизе солей, содержащих анионы:
a) F-, SO2-4, NO-3, PO3-4 — будет образовываться кислород;
'. б) Cl-, Br-, I- — будут образовываться соответствующие галогены; в) органических кислот — будет идти реакция:
2RCOO-®R—R+2СO2
2. На активном (растворимом) аноде, сделанном из металла, стоящего в ряду напряжений до серебра, будет происходить растворение материала анода (обычно параллельно с одной из реакций пункта 1)
9. На катоде при электролизе солей, содержащих катионы
а) аммония или металлов, стоящих в ряду напряжений до алюминия, будет выделяться водород;
б) металлов, стоящих в ряду напряжений после водорода, будет выделяться соответствующий металл;
. в) металлов, стоящих в ряду напряжений между алюминием и водородом, скорее всего будут совместно происходить выделение металла и водорода.
17.2.2. Электролиз расплава солей и оксидов
Для получения высокоактивных металлов (натрия, алюминия, магния, кальция и др.), легко вступающих во взаимодействие с водой, применяют электролиз расплава солей или оксидов:
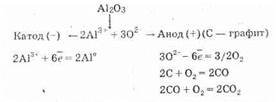
Если пропускать электрический ток через водный раствор активного металла и кислородсодержащей кислоты, то ни катионы металла, ни анионы кислотного остатка не разряжаются. На катоде выделяется водород, а на аноде — кислород, и электролиз сводится к электролитическому разложению воды.
Отметим наконец, что электролиз растворов электролитов проводить энергетически выгоднее, чем расплавов, так как электролиты — соли и щелочи — плавятся при очень высоких температурах.
17.2.3. Законы электролиза Фарадея
С количественной стороны процесс электролиза впервые был изучен в 30-х годах XIX века выдающимся английским физиком Фарадеем, который в результате своих исследований установил следующие законы электролиза:
1. Масса образующегося при электролизе вещества пропорциональна количеству прошедшего через раствор электричества.
Этот закон вытекает из сущности электролиза. Как уже говорилось, в месте соприкосновения металла с раствором происходит электрохимический процесс — взаимодействие ионов или молекул электролита с электронами металла, так что электролитическое образование вещества является результатом этого процесса. Ясно, что количество вещества, получающегося у электрода .всегда будет пропорционально числу прошедших по цепи электронов, т.е. количеству электричества.
2. При электролизе различных химических соединений равные количества электричества приводят к электрохимическому превращению эквивалентных количеств вещества.
Пусть, например, электрический ток последовательно проходит через растворы соляной кислоты, нитрата серебра, хлорида меди (II) и хлорида олова (IV). Через некоторое время определяют
количества выделившихся продуктов электролиза. Оказывается, что за время, в течение которого из раствора соляной кислоты выделяется 1 г водорода, т.е. 1 моль атомов, из остальных растворов выделяются указанные ниже массы металлов:
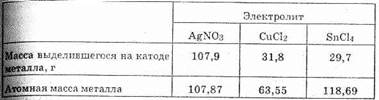
Сопоставляя выделившиеся массы с атомными массами тех же металлов, находим, что выделяется 1 моль атомов серебра, 1/2 моля атомов меди и 1/4 моля атомов олова. Другими словами, количества образовавшихся на катоде веществ равны их эквивалентам. К такому же выводу приводит и измерение количеств веществ, выделяющихся на аноде. Так, в первом, третьем и четвертом приборах выделяется по 35,5 г хлора, а во втором — 8 г кислорода; нетрудно видеть, что и здесь вещества образуются в количествах, равных их эквивалентам.
Рассматривая второй закон электролиза с точки зрения электронной теории, нетрудно понять, почему при электролизе вещества выделяются в химически эквивалентных количествах. Обратимся, например, к электролизу хлорида меди (II). При выделении меди из раствора каждый ион меди получает от катода два электрона, и в то же время два хлорид-иона отдают электроны аноду, превращаясь в атомы хлора. Следовательно, число выделившихся атомов меди всегда будет вдвое меньше числа выделившихся атомов хлора, т.е. массы меди и хлора будут относиться друг к другу как их эквивалентные массы.
Измерениями установлено, что количество электричества, обуславливающее электрохимическое превращение одного эквивалента вещества, равно 96485 (округленно 96500) кулонам. Это количество электричества называется Фарадеем и обозначается буквой F. Второй закон электролиза дает прямой метод определения «эквивалентов различных элементов. На этом же законе основаны расчеты, связанные с электрохимическими производствами. Зависимость количества вещества, образовавшегося под действием электрического тока, От времени, силы тока и природы электролита может быть установлена на основании обобщенного закона Фарадея:
m=(Э/F)•I•t=(M/n•F)•I•t,
где m — масса образовавшегося при электролизе вещества (г); Э — эквивалентная масса вещества (г/моль);М — молярная масса вещества (г/моль); n — количество отдаваемых или принимаемых электронов; I — сила тока (A); t — продолжительность процесса (с); F — константа Фарадея, характеризующая количества электричества, необходимое для выделения 1 эквивалентной массы вещества (F=96500 Кл/моль=26,8 А•ч/моль).
Законы электролиза относятся к электролизу растворов, расплавов и твердых электролитов с чисто ионной проводимостью. ,1
17.2.4. Применение электролиза
Электролиз находит весьма широкое применение. Для защиты металлических изделий от коррозии на их поверхность наносится тончайший слой другого металла — хрома, серебра, золота, меди, никеля и т.д. Иногда применяют многослойное покрытие. Например, внешние детали автомобиля сначала покрывают тонким слоем меди, на медь наносят тончайший слой никеля, а на него — слой хрома.
Нанесенные на металлы электролизом покрытия получаются ровными по толщине, прочными, служат долго, и, кроме того, таким способом можно покрывать изделия любой формы. Эту отрасль прикладной электрохимии называют гальваностегией. Кроме защиты от коррозии, гальванические покрытия иногда придают красивый декоративный вид предметам.
Другая отрасль электрохимии, близкая по принципу к гальваностегии, называется гальванопластикой. Это получение точных металлических копий с различных предметов. Предмет, с которого хотят изготовить копию, покрывают воском, дают воску застыть и получают восковую матрицу, на которой все углубления копируемого предмета будут выпуклостями. Внутреннюю поверхность матрицы покрывают тонким слоем графита, проводящим электрический ток. Этот графитовый катод опускают в ванную с раствором сульфата меди; анодом служит медь. При электролизе медный анод растворяется, а на катоде осаждается | медь. Таким образом получается точная копия предмета. С помощью гальванопластики изготовляют клише для печати, грампластинки, металлизируют различные предметы. Гальванотехника разработана русским ученым Б. С. Якоби (1838).
Электролиз используется для получения многих металлов — щелочных, щелочноземельных, алюминия, лантаноидов и др. также для очистки некоторых металлов от примесей.
Майкл Фарадей (1791 — 1867) — один из крупнейших английских физиков и химиков. Большая часть его работ относится к области электричества. Он установил законы электролиза, открыл явление электромагнитной индукции. Впервые получил в жидком виде ряд газов (хлор, аммиак и др.). Он открыл бензол и изобутилен.
Дата добавления: 2016-01-03; просмотров: 2406;
