Предмет химии. Задачи и значение химии. Место химии в естествознании

Д. И. Менделеев в 1871 г. в своих знаменитых «Основах химии» дал точное определение химии: «Химия — это учение об элементах и их соединениях».
Химия тесно связана с физикой. «И эти две науки, — писал М. В. Ломоносов, — так соединены между собой, что одна без другой в совершенстве быть не могут». Химия соприкасается также с другими естественными науками и особенно с геологией и биологией. На границе между химией и геологией возникла наука геохимия, изучающая распространенность и миграцию химических элементов в различных системах Земли. Между химией и биологией сформировались биохимия, бионеорганическая и биоорганическая химия, изучающие химические процессы в живых организмах. Космохимия изучает состав космических тел и миграцию элементов во Вселенной.
Веществ очень много: в настоящее время известно более 4 млн. органических и свыше 100 тыс. неорганических. Для облегчения их изучения их классифицируют по различным признакам. Так, все известные вещества можно разделить на три группы: простые, сложные и смеси. Существуют многие другие Классификации веществ.
Важнейшая задача химии — получение веществ с заранее заданными свойствами и интенсификация промышленных производств, создание безотходных технологий. Не менее важная задача ее — исследование энергии химических превращений.
Химию, изучаемую в средней общеобразовательной школе, можно разделить на три большие части: общую, неорганическую и органическую.

Химию можно назвать индустрией чудесных превращений. Она позволяет синтезировать материалы, которых нет в природе, использовать их для создания всевозможных машин и приборов, для строительства жилищ и производства товаров народного потребления.
Химическая промышленность выпускает синтетический каучук, пластические массы, искусственное волокно, искусственное топливо, красители, лекарственные вещества и многое другое.
В больших количествах производятся продукты основной химической промышленности — кислоты, щелочи, соли.
В сельском хозяйстве широко применяются минеральные удобрения, химические средства защиты растений и регуляторы их роста, химические добавки в корма животных и консерванты кормов, многие полимерные материалы.
С использованием химических методов получают материалы, являющиеся основой индустриализации страны, а также осуществляют их защиту от коррозии.
Возможности химии неисчерпаемы. Только из нефти можно получить свыше 20 тыс. органических веществ, а из каменного угля еще больше. Безгранично ее применение для производства широкого ассортимента товаров народного потребления. В наше время химическая промышленность выпускает продукцию более 50 тыс. наименований.
Исключительно велико значение химии в научном понимании картины мира. Химия подтвердила общие законы развития природы, общества и познания.
Глубокое знание химии необходимо специалистам всех отраслей экономики. Химия, наряду с физикой и математикой, составляет основу профессиональной подготовки специалистов высокой квалификации.
Химия и охрана окружающей среды
В конце XX века человечество столкнулось с серьезной проблемой вредного воздействия промышленности, транспорта, энергетики на окружающую среду. Это воздействие проявляется в глобальных масштабах. Происходит загрязнение среды обитания человека вредными отходами производства, выделяется избыточная энергия, истощаются природные ресурсы. Отрицательными следствиями этих процессов являются загрязнение воды и атмосферы, изменение климата в отдельных регионах Земли, уменьшение площадей пахотных земель (из-за загрязнения, эрозии, образования пустынь), вымирание многих видов животных и растений, ухудшение здоровья людей.
Наука, которая изучает отношение растительных и животных организмов, в том числе и человека, с окружающей средой, получила название экологии. Экология имеет тесную связь с химией. С одной стороны, химическое воздействие на окружающую среду наносит ей большой вред, но, с другой стороны, предупредить деградацию природы можно путем использования химических методов.
Химия и химическая промышленность являются одним из наиболее существенных источников загрязнения окружающей среды. Другими наиболее неблагоприятными в экологическом отношении производствами являются черная и цветная металлургия, автомобильный транспорт и энергетика (главным образом тепловые станции).
Каковы основные источники загрязнения среды обитания человека? Прежде всего отметим, что источники загрязнения бывают газообразными, жидкими и твердыми. Газообразные отходы производства образуются при сгорании топлива, выплавке металлов и в других процессах. Большой выброс вредных газов дают автомобильные двигатели внутреннего сгорания. Газообразные отходы содержат оксид углерода (IV) СО2, оксид углерода (II) СО, оксид серы (IV) SO2, оксиды азота и другие вредные вещества. В состав газообразных выбросов может входить пыль, содержащая углерод в виде сажи, и другие компоненты. В процессе сжигания топлива расходуется кислород из атмосферы, что также неблагоприятно сказывается на людях, особенно в тех местностях, где мало растений, вырабатывающих кислород.
Другой источник загрязнения окружающей среды — промышленные и бытовые сточные воды. Многие производства требуют больших количеств воды для промывки, охлаждения и других целей. После использования вода сбрасывается в водоемы. Сточные воды могут содержать многие неорганические соедине-
ния, в том числе ионы таких металлов, как ртуть, цинк, кадмий, медь, никель, хром и другие. Не менее опасно присутствие в сточных водах различных органических соединений. Химические вещества, содержащиеся в воде, попадают в реки, озера и моря, проникают в грунтовые воды, выносятся на поля. В результате эти вредные вещества появляются в питьевой воде и пище человека и животных, могут привести к отравлению и смерти, вызвать глубокие генетические изменения в организме.
Если сточные воды содержат безобидные, на первый взгляд, примеси, например хлорид натрия или сульфат натрия, то и они могут принести большой вред окружающей среде, вызывая засоление водоемов и почвы.
Третий источник загрязнения — твердые отходы. К ним относятся различные отходы, которые невозможно пустить на переработку, пустая порода — отходы горнодобывающей промышленности, строительный и бытовой мусор и т.д.
Для решения задач в области охраны окружающей среды необходимо осуществить комплекс мер, многие из которых решаются путем применения химических, физико-химических, физических и биологических методов. Важнейшие направления работ, которые проводятся для снижения отрицательного воздействия производственной деятельности, следующие:
Действующие производства
1. Разработка систем очистки выбрасываемых газов и сточных вод.
2. Разработка технологий переработки твердых отходов. Эти отходы часто являются ценным сырьем, содержащим отходы пластмасс, металлов, стекла, бумаги и других веществ. Многие твердые отходы или побочные продукты являются источником сырья для производства строительных материалов.
Новые предприятия
1. Разработка и создание малоотходных и полностью безотходных технологий. Для решения этой задачи необходимо проводить полную очистку всех выбросов, утилизировать и пускать обратно в производство все отходы и побочные продукты.
2. Разработка технологий, которые наиболее экономично расходуют сырье, топливо, энергетические ресурсы. Это существенно снизит нагрузку на окружающую среду.
3. Создание производственных процессов, которые не используют вредные химические вещества, а также не дают такие вещества в качестве побочных продуктов.
Охрана окружающей среды — глобальная проблема, захватывающая интересы всего мира, так как невозможно даже в крупной стране локализовать вредные последствия развития производства. Поэтому в настоящее время в области экологии развивается международное сотрудничество, многие проблемы решаются путем совместных действий различных государств.
Вещество
Вещество представляет собой однородный (гомогенный) вид материи, т.е. такой материи, каждая частица которой имеет одинаковые физические свойства (качества). Так, например, молоток или клещи имеют, правда, различные величину и форму, но оба предмета сделаны из железа, имеют одни и те же физические свойства, и вещество их одинаково.
Понятие вещества и понятие материала в данном случае приблизительно совпадают.
В химическом смысле под веществом мы подразумеваем материю абсолютно чистую, т.е. без всяких примесей. Атомы химических элементов могут существовать в свободном виде при очень высоких температурах — это одинаковые атомы, или в составе простых и сложных веществ.

Например, простое вещество уголь образовано атомами элемента углерода, простое вещество железо — атомами элемента железа, простое вещество азот — атомами элемента азота.
По агрегатному состоянию вещества делятся на твердые, жидкие и газообразные; по происхождению вещество может быть природным (например, каменная соль) и искусственным (вещество отсутствует в природе и синтезировано химическими или физическими способами, например, трансурановые элементы, некоторые пластмассы).

Из молекул состоят вещества в газообразном и парообразном состоянии; жидкости (вода, спирт, эфир и др.); твердые вещества, кристаллическая решетка которых имеет молекулярную структуру.
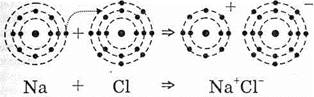
Рис.1. Схематическое изображение ионной связи.
Однако не всякое вещество состоит из молекул. В веществах, имеющих атомное или ионное строение, носителями химических свойств являются не молекулы, а комбинации ионов или атомов, которые образуют данное вещество. Не имеют молекулярной структуры соли, металлы, оксиды металлов, алмаз, кремний.

Атом — это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов.

Ионы образуются из атомов, например при образовании ионной связи.
При этой связи из нейтральных атомов образуются атомы электрически заряженные — так называемые ионы. Если наглядно изобразить, например, реакцию соединения натрия с хлором (рис. 1), то мы увидим, что в ней примут участие только электроны валентных сфер: атом натрия отдаст свой валентный электрон атому хлора и его внешний электронный слой приобретет конфигурацию октета (Ne) и станет положительно заряженным ионом, так называемым катионом (Na+). Электрически нейтральный атом Сl приобретает в свою валентную сферу валентный электрон натрия, дополняет конфигурацию до октета (Ar) и становится отрицательно заряженным ионом, анионом (Cl-).
Элементы, способные создавать таким образом катионы, называются электроположительными. Обычно это металлы (и водород). Элементы, способные принимать электроны, называются электроотрицательными. Как правило, это неметаллы.
Оба иона (катион и анион) свободно движутся в водном растворе или в расплаве (поэтому водный раствор NaCl и расплав NaCl электропроводны и подвергаются электролизу, т.е. разложению электрическим током), в кристалле же NaCl оба иона удерживаются электростатическими силами в кристаллической решетке. NaCl кристаллизуется в кубической системе, и его кристаллы состоят из мельчайших кубиков, в углах которых находятся попеременно ионы Na+ и Cl-. Внутри кристалла каждый Na+ окружен шестью ионами Cl-, так что нет смысла говорить о молекулах NaCl, ибо весь кристалл является собственно одной громадной молекулой. О молекулах NaCl в смысле атомной теории можно было бы говорить, если бы NaCl был в парообразном состоянии.
Так как в реакции соединения участвуют только валентные электроны, то соединение натрия с хлором мы можем изобразить так:

Таким образом можно изобразить и другие связи, например, соединение магния с кислородом:
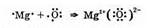

В настоящее время известно 107 элементов. Около 90 из них существует в природе. Остальные получены искусственно с помощью ядерных реакций. 104-107 элементы были синтезированы учеными-физиками в Объединенном институте ядерных исследований в Дубне и в Европейском центре ядерных исследований (CERN) в Швейцарии. В настоящее время продолжаются работы по искусственному получению химических элементов с более высокими порядковыми номерами.
Все элементы делятся на металлы и неметаллы. К металлам относятся 85 элементов.
К неметаллам относятся следующие элементы: гелий, неон, аргон, криптон, ксенон, радон, фтор, хлор, бром, иод, астат, кис-
лород, сера, селен, теллур, азот, фосфор, мышьяк, углерод, кремний, бор, водород.
Однако это деление условное. При определенных условиях некоторые металлы могут проявлять неметаллические свойства, а некоторые неметаллы — металлические свойства.
Следует различать понятия простого вещества и химического элемента.
Простое вещество характеризуется определенными химическими и физическими свойствами. В процессе химического превращения простое вещество утрачивает часть своих свойств и входит в новое вещество в виде элемента. Например, азот и водород, входящие в состав аммиака, содержатся в нем не в виде простых веществ, а в виде элементов.
Некоторые элементы объединяются в группы, например:
— органогены (основные элементы, входящие в состав органических веществ) — углерод, азот, кислород, водород;
— щелочные металлы — литий, натрий, калий, рубидий, цезий, франций;
- щелочноземельные металлы — кальций, стронций, барий, радий;
— лантаноиды — лантан, церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий, лютеций;
— галогены — фтор, хлор, бром, иод, астат;
— инертные элементы — гелий, неон, аргон, криптон.
Содержание различных элементов в природных объектах колеблется в широких пределах. 8 химических элементов (кислород, кремний, алюминий, железо, кальций, натрий, калий и магний) составляют 99% земной коры по массе, все остальные — менее 1%.
В 1889 г. американский ученый Ф. У. Кларк впервые вычислил химический состав земной коры (условно до глубины 16 км) в массовых долях (%). Большой вклад в уточнение состава земной коры внесли В. И. Вернадский, А. Е. Ферсман, В. Ноддак и др. Преобладающие элементы в космосе — водород и гелий.
Д. И. Менделеев впервые установил, что наибольшее распространение в природе имеют элементы «малого атомного веса» (атомной массы), в организмах же исключительно преобладают легчайшие (Н, С, N, О).
Химическая формула
Состав простых и сложных веществ изображается при помощи химических формул.

Формула простого вещества показывает, из скольких атомов состоит его молекула: формула водорода Н2. Если атомный состав молекулы простого вещества неизвестен, если простое вещество имеет не молекулярное, а атомное или металлическое строение, то его обозначают химическим знаком элемента. Например: Р, С, Аl.
Формула сложного вещества Н2О обозначает одну молекулу воды; формула показывает, что 1 моль воды образован из 2 молей атомов водорода и 1 моля атомов кислорода.
Химическую формулу вещества устанавливают на основании анализа его состава.
Моль. Молярная масса
В химии чрезвычайное значение имеет особая величина — количество вещества.
Количество вещества определяется числом структурных единиц (атомов, молекул, ионов или других частиц) этого вещества, оно обозначается обычно n (греч. — ню) и выражается в молях (моль).

Для удобства расчетов, проводимых на основании химических реакций и учитывающих количества исходных реагентов и продуктов взаимодействия в молях, вводится понятие молярной массы.
Молярная масса М вещества представляет собой отношение его массы к количеству вещества, выраженному в молях:
M=m/n,
где m — масса в граммах, n — количество вещества в молях, М — молярная масса в г/моль — постоянная величина для каждого данного вещества.
Значение молярной массы численно совпадает с относительной молекулярной массой элемента.
| <== предыдущая лекция | | | следующая лекция ==> |
| Конспект Электрическое поле | | | Особенности химии переходных элементов. |
Дата добавления: 2016-01-03; просмотров: 4362;
