Кулонометричний аналіз
Цей аналіз заснований на тому, що проводиться електроліз досліджуваної речовини в розчині і при цьому визначається кількість електрики, яка витрачається на електрохімічне окиснення чи відновлення йонів, що визначаються. Результати аналізу розраховують за законом Фарадея:
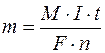 ,
,
де m – маса речовини, що виділяється на електроді, г;
M – молярна маса речовини, г/моль;
I – сила струму, А;
t – час електролізу, с;
F – число Фарадея, 96500К;
n – кількість електронів, що беруть участь в електрохімічному окисненні-відновленні.
Оскільки I·t (ампер-секунда) це кулон, то:
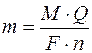 ;
;
де Q – кількість електрики, Кулон.
Гальванометри здатні вимірювати дуже малі струми – 10–7-10–8А. Тому кулонометричним методом можна визначати ультрамікрокількості речовини, соті та тисячні частки мікрограма.
При кулонометричному визначенні необхідно створювати такі умови електролізу, щоб струм витрачався тільки на основну електрохімічну реакцію, тобто щоб повністю були виключені побічні процеси, що протікають із затратою електрики. Слід строго контролювати зовнішню напругу, яка повинна забезпечити електроліз речовини, що аналізується, і в той же час бути недостатньою для проходження побічних електрохімічних реакцій. Необхідно також уникати електрохімічного розкладення води.
У кулонометричному аналізі важливим є те, що необхідно точно встановити момент, коли окиснення чи відновлення досліджуваної речовини практично повністю закінчено.
Момент кількісного завершення даної електрохімічної реакції встановлюється різними способами.
1. Метод кольорових індикаторів. У досліджуваний розчин вводять реактив, який утворює забарвлену сполуку з речовиною, що аналізується. Тоді закінчення електролізу буде відмічено зникненням характерного забарвлення розчину.
2. Потенціометричний метод. У досліджуваний розчин занурюють електрод, потенціал якого залежить від концентрації одного з реагуючих компонентів. Під час електролізу вимірюють потенціал цього електрода, включеного в окремий ланцюг. У кінці електролізу потенціал індикаторного електрода різко змінюється; в цей момент струм вимикають.
Окрім прямих кулонометричних методів широко розповсюджений метод кулонометричного титрування. Суть методу полягає у тому, що паралельно з електрохімічною реакцією, що протікає під дією електричного струму, у розчині відбувається також хімічна реакція між речовиною, що визначається, та продуктом електрохімічної реакції. Електроліз проводять у присутності великого надлишку сторонніх йонів, здатних до більш легкого електрохімічного окиснення – відновлення, ніж йони, що визначаються. Таким засобом виключають небажані побічні реакції, головна з яких – електрохімічне розкладання води.
Кулонометричне титрування має у ряді випадків значні переваги над звичайним титруванням. Не треба заздалегідь готувати робочі розчини та встановлювати їх точну концентрацію. Як генеруючі титрувальні речовини можуть застосовувати речовини, які малостійкі при звичайних умовах і тому непридатні для приготування робочих розчинів. Різні окисники легко визначати генерованими йонами Sn2+, Cu+, Cr2+ та ін. Для титрування відновників застосовують генеровані вільний бром і йод, фериціанід та ін.
Кількість електрики в кулонометрії вимірюють кулонометрами, які включають у ланцюг послідовно з коміркою для електролізу, а також хронометричним методом. Останній ґрунтується на тому, що протягом усього електролізу підтримують силу струму незмінною, а тривалість електролізу визначають секундоміром. Кількість електрики розраховують як добуток сили струму на час електролізу:
Q = I·t.
Цей спосіб більш чутливий, ніж вимірювання кулонометрами.
Дата добавления: 2015-12-26; просмотров: 1113;
