Флуорометричний аналіз
Флуорометрія базується на вимірюванні фотолюмінесценції (флуоресценції) досліджуваного розчину.
Є дві групи люмінесцентного аналізу: аналіз, заснований на безпосередньому спостереженні люмінесціюючого матеріалу, і аналіз, який проводиться після переведення досліджуваного компонента в люмінесціюючу сполуку. Друга група методів люмінесцентного аналізу близька до фотометричного аналізу. У обох випадках необхідно перевести досліджуваний компонент у сполуку, яка б у найбільшій мірі поглинала світло. При фотометричному аналізі вимірюють безпосередньо послаблення інтенсивності світлового потоку. У люмінесцентному аналізі цю реакцію можна використати тільки у тому випадку, коли значна частина поглинутої енергії виділяється не у вигляді тепла, а у вигляді світла.
Флуоресценція – свічення, яке виникає при опроміненні деяких речовин електромагнітними хвилями і одразу ж зникає після припинення цього опромінення. Під впливом квантів такого опромінення молекули і атоми переходять у збуджений стан. Через деякий проміжок часу (близько 10–12с) молекули повертаються в основний стан. При цьому відбувається випромінювання енергії у вигляді квантів теплового випромінювання, що призводять до стабілізації молекули на нижньому збудженому рівні, а потім відбувається випромінювання квантів внаслідок повернення молекули в основний стан. Таким чином, енергія (частота) флуоресцентного випромінювання повинна бути меншою, ніж енергія (частота) збуджуючого опромінення:
hν = hν0 – hνT.
Це явище має назву закону Стокса-Ломмеля.
Ефективність перетворення енергії поглинутого світла в енергію люмінесценції характеризується енергетичним та квантовим виходами люмінесценції. Відношення випромінюваної енергії люмінесценції до енергії поглинутого світла називається енергетичним виходом люмінесценції, а відношення числа випромінюваних квантів до числа поглинутих називається квантовим виходом люмінесценції.
Якщо Вен – енергетичний, а Bкв – квантовий вихід люмінесценції, Eл та Eс – відповідно енергія люмінесценції та енергія поглинутого світла, а Nл і Nс – число випущених та поглинутих квантів, то
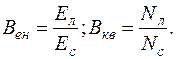
Враховуючи, що енергія N квантів дорівнює E=Nhν:
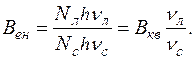
У відповідності із законом Стокса-Ломмеля, спектр флуоресценції та його максимум завжди зсунуті відносно спектра поглинання та його максимуму у довгохвильову область спектра. Тому речовини, що поглинають випромінювання в ультрафіолетовій частині спектра, будуть флуоресціювати світлом видимої області спектра; речовини, флуоресценція яких збуджується світлом видимої частини спектра, будуть флуоресціювати у більш довгохвильовій області спектра.
Відстань між максимумом спектра поглинання та максимумом спектра флуоресценції називається стоксовим зсувом. Чим він більший, тим надійніше визначення речовини флуоресцентним методом.
Кількісний аналіз базується на залежності інтенсивності флуоресценції розчинів від концентрації флуоресціюючої речовини. В області концентрацій 10–7-10–4моль/дм3 ця залежність має лінійний характер – описується рівнянням:
F = I0·2,3ε·b·c·φ,
де F – інтенсивність флуоресценції, квант/с;
I0 – інтенсивність збуджуючого світла, квант/с;
ε – молярний коефіцієнт поглинання;
b – товщина флуоресцентного шару, см;
с – концентрація розчину, моль/дм3;
φ – квантовий вихід флуоресценції, що залежить від природи речовини.
За умови, що I0, ε, b, φ – постійні величини, то:
F = K·c.
При високих концентраціях розчину (>10–4моль/дм3) лінійна залежність не виконується.
Інтенсивність флуоресценції залежить від природи речовини, температури, pH середовища, присутності у розчині домішок, що викликають гасіння флуоресценції.
Кількісний флуоресцентний аналіз потрібно проводити при невисоких температурах та певних значеннях pH. Метод використовується для визначення малих кількостей неорганічних та органічних речовин: антибіотиків, вітамінів, гормонів тощо.
Інтенсивність флуоресценції досліджуваних речовин визначають за допомогою флуорометрів.
Дата добавления: 2015-12-26; просмотров: 1849;
