Приготування робочого розчину перманганату
Спочатку за розрахованою наважкою готують розчин з приблизною концентрацією. Цей розчин повинен довго постояти щоб у ньому відбулися процеси окиснення можливих домішок, а також процеси самоокиснення-самовідновлення різних форм Мангану. Після стабілізації концентрації розчину перманганату установлюють його точну концентрацію (титр) за установочною речовиною (первинним стандартом). Як установочні речовини використовують: щавлеву кислоту H2C2O4·2H2O х.ч.; натрій оксалат, висушений при 105-110ºС у сушильній шафі протягом 2 годин; амоній оксалат (NH4)2C2O4·H2O; сіль Мора (NH4)2[Fe(SO4)2]·6H2O; калій гексаціано (ІІ) ферат K4[Fe(CN)6]·3H2O та ін.
Для установлення титру розчину перманганату також застосовують йодометричний метод титрування. При взаємодії KMnO4 з KI виділяється еквівалентна кількість йоду, який відтитровують стандартним розчином натрій тіосульфату.
При титруванні у кислому середовищі застосовують для підкислення середовища розведені розчини сульфатної чи фосфатної кислот. При титруванні солей Fe2+ краще застосовувати фосфатну кислоту, яка зв’язує йони Fe3+, що при цьому утворюються, у безбарвні комплекси, що покращує встановлення точки еквівалентності.
Робочий титрований розчин перманганату можна одержати також з фіксаналу.
Титрування перманганатом можна проводити прямим, зворотним методами, непрямим методом.
Прямим методом титрування визначають відновники, які легко і без втрат окиснюються перманганатом. Зворотне титрування застосовують для визначення відновників, які окиснюються перманганатом повільно, а також окисників, які попередньо відновлюються відповідними відновниками до сполук нижчих ступенів окиснення.
Для визначення багатьох речовин, що не окиснюються перманганатом у строго еквівалентних кількостях і для яких не можна застосувати методи зворотного титрування, застосовують непрямі методи титрування перманганатом. У цьому випадку досліджувану речовину окиснюють, наприклад, сполуками Fe3+ (залізний галун). Утворені при цьому в еквівалентній кількості йони Fe2+ по відношенню до досліджуваної речовини потім титрують перманганатом:
Fe3+ + досліджувана речовина " Fe2+ + досліджувана речовина окиснена;
Fe2+ + 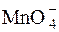 + 8H+ " Fe3+ + Mn2+ + 4H2O.
+ 8H+ " Fe3+ + Mn2+ + 4H2O.
Позитивні сторони перманганатометрії:
1. Вихідні стандартні розчини перманганату забарвлені у червоно-фіолетовий колір, тому кінцеву точку титрування можна визначити за появою рожевого забарвлення розчину досліджуваної речовини від понадеквівалентної краплі титранту при титруванні прямим методом чи по зникненню забарвлення при титруванні зворотним методом без застосування індикаторів.
2. Титрування можна вести в кислому чи лужному середовищі. Перманганат має високий редокс-потенціал 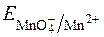 =+1,52B, тому багато речовин, які не можна відтитрувати розчинами більш слабких окисників, можна визначити перманганатометричним методом.
=+1,52B, тому багато речовин, які не можна відтитрувати розчинами більш слабких окисників, можна визначити перманганатометричним методом.
3. Перманганат є дешевим і легкодоступним реагентом.
4. Перманганат можна застосовувати для визначення речовин, які не мають окисно-відновних властивостей. Наприклад, для визначення йонів Са2+ у досліджуваному розчині їх осаджують у вигляді малорозчинного кальцій оксалату. Осад кальцій оксалату відділяють від розчину, промивають, розчиняють у сульфатній кислоті і оксалат-іони відтитровують перманганатом. Роблять відповідні розрахунки вмісту йонів Кальцію.
Негативні сторони перманганатометрії:
1. Вихідний реагент – КМnО4 неможливо отримати в хімічно чистому стані внаслідок впливу забруднюючих відновників і процесів самоокиснення-самовідновлення різних форм Мангану. Тому за наважкою кристалічного KMnO4 чи іншої солі манганової кислоти приготувати титрований розчин, стандартний розчин, неможливо. Титр розчину перманганату установлюють за допомогою первинних стандартів чи готують робочий розчин перманганату з фіксаналу.
2. Стандартні розчини перманганату не стійкі, з часом міняють свій титр, тому перед використанням слід установлювати титр розчину перманганату, який певний час вже зберігався.
3. Титрування перманганатом не рекомендується проводити за наявності у розчині хлорид-іонів, які окиснюються перманганатом до вільного хлору. Не можна для підкислення досліджуваного розчину застосовувати хлоридну кислоту.
4. Деякі реакції окиснення перманганатом протікають при кімнатній температурі дуже повільно. Тому треба розчин, який титрують, нагрівати.
5. Стан динамічних рівноваг, які установлюються у процесі титрування перманганатом, залежить від різних факторів, тому дослідження необхідно проводити при строго визначених умовах, які рекомендуються методикою аналізу.
Броматометрія
За цим методом для визначення відновників як титрант використовується розчин калій бромату KBrO3.
Бром у складі бромат-іона відновлюється до бромід-іона, окиснюючи при цьому певний відновник:
BrO3−+ 6ē + 6H+ D Br− + 3H2O;  = +1,45В.
= +1,45В.
У кислому середовищі бромат-іони окиснюють бромід-іони до вільного брому:
BrO3− + Br− + 6H+ D Br2 + 3H2O.
Стандартний (титрований) робочий розчин калій бромату можна готувати як первинний стандарт, оскільки кристалічний KBrO3 відповідає вимогам до первинних стандартів. Розчин може бути приготований за наважкою KBrO3.
Як індикатори в броматометрії використовують метилоранж, метиловий червоний, індиго сульфокислоту та ін., які незворотно окиснюються бромат-іонами до безбарвних продуктів від надлишкової краплі титранту.
Робочий розчин калій бромату можна стандартизувати йодометричним методом: бромат-іони окиснюють йодид-іони, при цьому утворюється еквівалентна бромат-іонам кількість вільного йоду, який відтитровують тіосульфатом.
Хроматометрія
Метод застосовується для визначення відновників з використанням калій дихромату як титранту.
У кислому середовищі дихромат-іони окиснюють відповідні відновники. При цьому 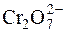 відновлюється до Cr3+:
відновлюється до Cr3+:
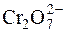 + 6ē + 14H+ D 2Cr3+ + 7H2O;
+ 6ē + 14H+ D 2Cr3+ + 7H2O;  = +1,33В.
= +1,33В.
Стандартний розчин K2Cr2O7 готують як первинний стандарт за наважкою K2Cr2O7. Як індикатори застосовують дифеніламін, фенілантранілову кислоту та ін.
Для визначення кінцевої точки титрування за цим методом використовують також інструментальні методи (потенціометричний, кондуктометричний, амперометричний та ін.).
Нітритометрія
Метод заснований на окиснювально-відновних властивостях нітратної (ІІІ) кислоти та її здатності діазотувати аміни.
При діазотуванні первинних амінів утворюються солі діазонію:
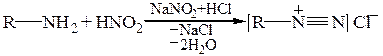
При дії нітратної (ІІІ) кислоти на вторинні аміни утворюється нітрозосполуки
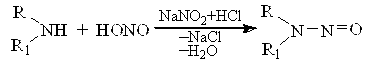
Нітрити лужних металів, в залежності від умов, проявляють окиснювальні або відновні властивості.
Такі окисники як KMnO4, H2O2, Ce4+ та інші окиснюють нітрит-іони до нітрат-іонів:
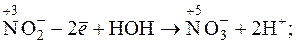
 = +0,94В;
= +0,94В;
Відновники, наприклад сульфамінова кислота, відновлюють NO2− до N2:
2  + 8H+ " N2# + 4H2O;
+ 8H+ " N2# + 4H2O;  = +1,44В;
= +1,44В;
NaNO2 + NH2SO2OH " N2 + NaHSO4 + H2O.
Титрантом методу є розчин NaNO2, c( 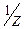 NaNO2)=0,1моль/дм3, який готують як вторинний стандарт, оскільки NaNO2 не стійкий, швидко розкладається.
NaNO2)=0,1моль/дм3, який готують як вторинний стандарт, оскільки NaNO2 не стійкий, швидко розкладається.
Стандартизують робочий розчин за сульфаніловою кислотою, п-амінобензойною кислотою, гідразинсульфатом і калій перманганатом за методом зворотного титрування.
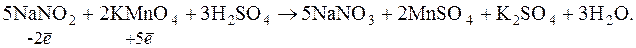
Надлишок KMnO4 визначається йодометричним методом.
У нітритометрії використовують внутрішні індикатори: дифеніламін, тропеолін ОО та ін. Як зовнішній індикатор використовують йодкрохмальний папір. Після досягнення точки еквівалентності, коли в розчині з’являється зайва кількість титранту, нітрит-іони окиснюють йодид-іони до вільного йоду і йодкрохмальний папір синіє:
 + 2I– + 2H+ " I2 + NO + H2O.
+ 2I– + 2H+ " I2 + NO + H2O.
Нітритометричний метод використовують для визначення багатьох фармацевтичних препаратів, що містять ароматичну аміногрупу Ar–NH2: новокаїну, сульфаніламідних препаратів, п-амінобензойної кислоти та ін.
Оскільки діазосполуки стійкі тільки при низьких температурах, нітритометричне титрування слід проводити при температурах 0-10ºС у присутності значної кількості хлоридної кислоти. Титрують у присутності каталізатора – кристалічного KBr повільно, енергійно перемішуючи розчин.
Церіметрія
Церіметрією називають метод титриметричного аналізу, у якому як окисник використовують сполуки Церію зі ступенем окиснення Се4+.
Для приготування стандартних розчинів у церіметрії використовують переважно комплексні амонієві солі Церію (ІV): гексанітратоцерат (ІV) – (NH4)2[Ce(NO3)6]; трисульфатоцерат (ІV) – (NH4)2[Ce(SO4)3]; гексахлорцерат (ІV) – (NH4)2[CeCl6]; гексаперхлоратоцерат – (NH4)2[Ce(ClO4)6].
Редокс-потенціали системи Ce4+/Ce3+ залежать від характеру лігандів при Се4+:
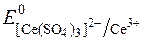 = +1,45В;
= +1,45В;
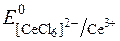 = +1,40В;
= +1,40В;
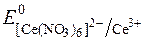 = +1,60В;
= +1,60В;
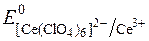 = +1,70В.
= +1,70В.
Високі редокс-потенціали системи Се4+/Се3+ дозволяють проводити майже всі визначення, які можливі у перманганатометрії, а також багато сполук, які не можна визначити іншими редокс-методами.
Церіметрія має ряд переваг перед іншими редокс-методами:
§ сполуки, що застосовуються для приготування стандартних розчинів, стійкі, не гігроскопічні, не взаємодіють з СО2 і О2 повітря, не вивітрюються, мають високі відносні молекулярні маси;
§ стандартні розчини довгий час зберігають постійність титру;
§ титрування розчинами солей Церію (ІV) можна проводити у присутності йонів Сl– (НСl), що неможливо у перманганатометрії;
§ при титруванні розчинами солей Церію (ІV), як правило, не утворюються проміжні і побічні продукти.
Недоліками методу є те, що за наявності у досліджуваному розчинні йонів F– утворюються стійкі комплексні йони [CeF6]2–, а при титруванні у присутності йонів PO43– при недостатній кислотності розчину утворюється нерозчинний церій (ІV) фосфат, внаслідок чого результати аналізу будуть невірними. Титрування у церіметрії часто необхідно проводити при нагріванні до 50-75ºС, що обмежує визначення летких органічних сполук.
Для стандартизації робочих розчинів у церіметрії використовують первинний стандарт – розчин щавлевої кислоти:
Се4+ + 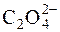 " 2СО2 + Се3+.
" 2СО2 + Се3+.
У церіметрії можливе пряме, зворотне титрування і титрування замісника.
Кінцеву точку титрування у церіметрії визначають безіндикаторним методом, який полягає у візуальному спостереженні забарвлення досліджуваного розчину від зайвої краплі титранту, який має жовте забарвлення (Се4+), тоді як сполуки Се3+ – безбарвні. Але цей метод не можна застосувати при дослідженні забарвлених, мутних розчинів, а також тоді, коли в результаті реакції з’являються забарвленні продукти реакції.
Індикаторні методи визначення кінцевої точки титрування ґрунтуються на застосуванні редокс-індикаторів – фероїну, 2,2′-дипіридилу, дифеніламіносульфокислоти та ін., а також необоротних кислотно-основних індикаторів – метилового оранжевого, метилового червоного та ін.
Для визначення кінцевої точки титрування у цьому методі застосовують фізико-хімічні засоби: потенціометрію, фотометрію, амперометрію та ін.
Йодхлориметрія
Титрантом методу є розчин йодмонохлориду ICl, який є окисником. Йод зі ступенем окиснення 1+, окиснюючи різноманітні відновники, сам може відновлюватись до І2 або І–:
ICl + 2ē = I– + Cl–; Eº = +0,795B;
2ICl + 2ē = I2 + 2Cl–; Eº = +1,19B.
Редокс-потенціал системи залежить від концентрації хлоридної кислоти, яка є обов’язковим компонентом системи.
Йодхлориметричне титрування схоже на йодометрію, але має переваги:
§ розчини йодмонохлориду більш стійкі, ніж розчини йоду;
§ редокс-потенціал 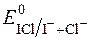 >
> 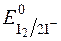 (0,795 і 0,545 В відповідно).
(0,795 і 0,545 В відповідно).
Цим методом можна визначати ціаніди, гексаціаноферати(ІІ), тіосечовину, сульфамідні препарати, барбітурати, похідні ароматичних амінів, фенолів та ін.
Титрант готується як вторинний стандартний розчин. Його отримують окисненням йодид-іонів йодат-іонами у середовищі концентрованої хлоридної кислоти:
2I– +  + 6H+ + 3Cl– " 3ICl + 3H2O.
+ 6H+ + 3Cl– " 3ICl + 3H2O.
Розчин йодмонохлориду стійкий у середовищі хлоридної кислоти (не менше 100см3 концентрованої НСl в 1000см3 приготованого розчину). Робочий розчин йодмонохлориду можна стандартизувати за стандартними речовинами: As2O3; K4[Fe(CN)6]; KI; Na2S2O3 та ін.
У йодхлориметрії застосовують пряме, зворотне титрування і титрування замісника.
Прямим титруванням визначають сильні відновники: Sn2+, SCN–, 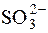 , аскорбінову кислоту та ін.
, аскорбінову кислоту та ін.
Зворотне титрування застосовують для визначення Fe2+, Hg2Cl2 та ін. До розчину, що титрують, додають надлишок ICl. Йодмонохлорид, що залишився після окиснення даного відновника, визначають йодометрично:
ICl +I– " I2 + Cl–;
I2 + 2  " 2I– +
" 2I– +  .
.
Кінцеву точку титрування визначають з індикатором – розчином крохмалю і фізико-хімічними методами: потенціометричним, амперометричним та ін.
Йодометрія
Робочими розчинами в йодометрії є розчин йоду і натрій тіосульфату.
Окисником в йодометрії є йод. Він окиснює всі відновники, редокс-потенціал яких менше 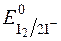 = +0,5345В:
= +0,5345В: 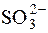 ,
,  ,
, 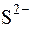 , CN–, SCN–, Cr2+ та ін.
, CN–, SCN–, Cr2+ та ін.
Кристалічний йод малорозчинний у воді, тому для приготування стандартного розчину застосовують його розчин в КІ. При розчиненні йоду в калій йодиді утворюються [І3]–-іони, у яких йод зберігає окисні властивості. Нормальний редокс-потенціал системи 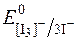 = +0,5355В, тобто окисно-відновні потенціали систем І2/2І– і [І3]–/3І– практично є рівними.
= +0,5355В, тобто окисно-відновні потенціали систем І2/2І– і [І3]–/3І– практично є рівними.
Схему реакції, що протікає при йодометричних вимірюваннях, можна представити так:
[І3]– + 2ē = 3І–
Редокс-потенціал цієї системи не залежить від концентрації Н+-іонів, якщо реакції відбуваються в кислих розчинах.
Однак багато речовин, що містять у своєму складі атоми Оксигену, і вступають в реакції з йодид-іонами, у присутності Н+-іонів реагують з утворенням води. Наприклад:
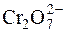 + 2I– + 14H+ " 2Cr3+ + I2 + 7H2O.
+ 2I– + 14H+ " 2Cr3+ + I2 + 7H2O.
Тому окисно-відновні потенціали таких систем сильно залежать від концентрації у розчині Н+-іонів:
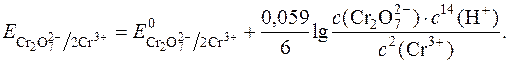
Як відновник в йодометрії є натрій тіосульфат, який реагує з йодом за рівнянням:
I2 + 2  " 2I– +
" 2I– +  .
.
Розчин тіосульфату використовують для титрування надлишку йоду, що додається у процесі титрування деяких відновників (наприклад 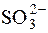 ), або йоду, що утворюється при окисненні йодидів окисниками. Наприклад:
), або йоду, що утворюється при окисненні йодидів окисниками. Наприклад:
Cl2 + 2I– → 2Cl– + I2.
Речовини, що легко окиснюються йодом, тобто такі, редокс-потенціали систем яких менші 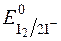 , титрують безпосередньо стандартними розчинами йоду в калій йодиді. Такі методи визначення називаються методами прямого йодометричного титрування. За цим методом визначають сульфіди, тіосульфати і інші сильні відновники.
, титрують безпосередньо стандартними розчинами йоду в калій йодиді. Такі методи визначення називаються методами прямого йодометричного титрування. За цим методом визначають сульфіди, тіосульфати і інші сильні відновники.
Речовини, які повільно окиснюються йодом, тобто такі, редокс-потенціал систем яких наближається за своїм значенням до 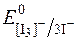 , визначають методом зворотного йодометричного титрування. Для цього до досліджуваного розчину додають відомий надлишок розчину K[I3], а потім, через деякий час, достатній для окиснення досліджуваної речовини, відтитровують надлишок К[І3] стандартним розчином натрій тіосульфату.
, визначають методом зворотного йодометричного титрування. Для цього до досліджуваного розчину додають відомий надлишок розчину K[I3], а потім, через деякий час, достатній для окиснення досліджуваної речовини, відтитровують надлишок К[І3] стандартним розчином натрій тіосульфату.
До розчину речовин, редокс-потенціал систем яких більше 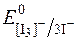 , додають надлишок калій йодиду чи натрій йодиду, а потім йод, що при цьому виділився в еквівалентній кількості, відтитровують стандартним розчином натрій тіосульфату. Такі методи визначення називаються методами непрямого йодометричного визначення. Наприклад:
, додають надлишок калій йодиду чи натрій йодиду, а потім йод, що при цьому виділився в еквівалентній кількості, відтитровують стандартним розчином натрій тіосульфату. Такі методи визначення називаються методами непрямого йодометричного визначення. Наприклад:
2KMnO4 + 10KI + 8H2SO4 " 2MnSO4 + 5I2 + 6K2SO4 + 8H2O;
5I2 + 10Na2S2O3 " 10NaI + 5Na2S4O6.
За таким методом визначають також хромати, дихромати, йодати, Cl2, Br2, Cu2+, Fe3+ і інші окисники.
Йодометричне визначення кислот
Йодиди з йодатами реагують у присутності кислот:
5I– +  + 6H+ " 3I2 + 3H2O.
+ 6H+ " 3I2 + 3H2O.
Використовуючи цю реакцію, можна визначити кислоти йодометричним методом.
Недоліками йодометричного методу є те, що титрування треба проводити в умовах, щоб запобігти втрати йоду через його леткість, при охолодженні і по можливості швидко. Деякий надлишок КІ зменшує ці помилки титрування. Не дозволяється проводити титрування у хімічному стакані, а тільки у колбі. Недоліком методу є те, що йодид-іони окиснюються киснем повітря:
4І– + О2 + 4Н+ D 2І2 + 2Н2О.
Окисненню І– сприяє зменшення pH розчину і дія сонячного світла. Тому йодометричне титрування слід проводити при невеликій кислотності розчину. При зберіганні стандартних (титрованих) розчинів йоду слід захищати їх від дії прямого сонячного світла і зберігати у посудині з темного скла.
Деякі речовини (Cu2+,  та ін.) індукують окиснення І– киснем повітря.
та ін.) індукують окиснення І– киснем повітря.
Гідроксид-іони викликають реакцію диспропорціювання йоду:
І2 + 2NaOH D NaІO + NaI + H2O.
Тому йодометричне титрування не можна проводити у лужному середовищі.
Недоліком йодометричного титрування є повільна реакція окиснення йодидів окисниками або відновлення І2 відновниками.
Поверхнево-активні речовини і деякі осади, що утворюються в процесі йодометричного титрування, можуть адсорбувати йод. Тому треба енергійно збовтувати розчин у процесі титрування.
У процесі зберігання титри стандартних розчинів йоду і тіосульфату змінюються. Необхідно перед аналізом перевіряти титр тіосульфату за дихроматом, а йоду – за тіосульфатом.
Кристалічний Na2S2O3·5H2O легко втрачає кристалізаційну воду, тому його стандартний розчин за точною наважкою приготувати неможливо. Натрій тіосульфат у розчині розкладається вуглекислотою:
Na2S2O3 + CO2 + H2O " NaHCO3 + NaHSO3 + S.
Стандартний розчин натрій тіосульфату слід захищати від СО2 за допомогою хлоркальцієвої трубки. Перед установкою титру розчин натрій тіосульфату повинен постояти близько 2 днів.
Титр розчину тіосульфату може змінюватися внаслідок розкладання речовини під дією кисню повітря:
2Na2S2O3 + O2 " 2Na2SO4 + 2S.
Титрований розчин йоду не можна приготувати розчиненням йоду у воді, тому що його розчинність складає лише 0,028г на 100г води при 20ºС. Але йод добре розчиняється у водному розчині калій йодиду з утворенням К[І3], у якому комплексний йон є сильним окисником. Тому титрований розчин йоду готують розчиненням наважки йоду в концентрованому розчині калій йодиду. Титр отриманого розчину встановлюють за стандартним розчином натрій тіосульфату у присутності індикатора крохмалю. Індикатор додають в кінці титрування щоб у процесі титрування йод не відволікався і на окиснення крохмалю. Якщо ж додати крохмаль на початку титрування, то результати титрування натрій тіосульфатом розчину йоду будуть заниженими.
Аскорбінометрія
Цей метод титриметричного аналізу застосовують для визначення окисників за допомогою стандартного робочого розчину аскорбінової кислоти, яка має сильні відновні властивості.
Розчин аскорбінової кислоти застосовується для прямого титрування розчинів окисників. При цьому аскорбінова кислота (АК) окиснюється до дегідроаскорбінової кислоти (ДГАК):
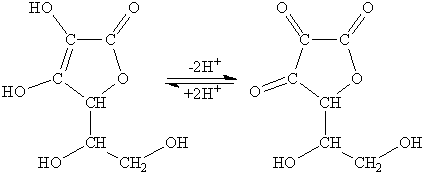
Аскорбінова кислота є похідним L-гулонової кислоти: 2,3-ендіол-1,4-лактону-L-гулонової кислоти. Кислотний характер аскорбінової кислоти обумовлений енольними гідроксилами ( 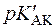 =4,17;
=4,17;  =11,57).
=11,57).
Нормальний редокс-потенціал системи АК/ДГАК ( 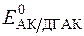 = +0,18В).
= +0,18В).
При дії відновників дегідроаскорбінова кислота, яка утворюється при окисненні аскорбінової кислоти, знову відновлюється до аскорбінової кислоти, тобто редокс-система АК/ДГАК зворотна. Окисно-відновний потенціал цієї системи у значній мірі залежить від pH розчину. З підвищенням кислотності розчину він збільшується.
При дії сильних окисників аскорбінова кислота може окиснюватись до L-треонової і щавлевої кислоти:
| АК " ДГАК " | 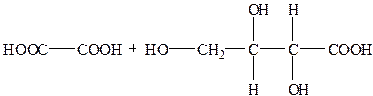
|
При окисненні аскорбінової кислоти до дегідроаскорбінової не сильними окисниками фактор еквівалентності fекв(АК) = ½, а еквівалент fекв(АК)АК = ½АК.
Аскорбінова кислота відновлює багато неорганічних і органічних речовин: Fe3+, Hg2+, Ag+, Au3+, I2, хлорати, бромати, йодати, ванадати, церати, розчинений у розчинниках О2, нітро-, нітрозо-, азо-, аміногрупи, індофеноли та ін.
Оскільки аскорбінова кислота здатна відновлювати вільний йод, вона може замінювати натрій тіосульфат у йодометричному методі. При цьому замість крохмалю як індикатор застосовують варіаміновий синій, який знебарвлюється в кінці титрування.
Розділ 13
Запитання і вправи з титриметричних методів аналізу
§ 65. Запитання для самоперевірки
1. Стандартизувати розчин HCl можна за титрованими розчинами NaOH чи Na2B4O7·10H2O. Який з цих способів забезпечить більш високу точність і чому?
2. Визначити фактори еквівалентності учасників наступних реакцій:
а) Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O;
в) Na3PO4 + H2SO4 = NaH2PO4 + Na2SO4;
в) 2KMnO4 + 3H2O2 + H2SO4 = 2MnO2 + 3O2 + K2SO4 + 4H2O.
3. У якому з наведених титрувань точка еквівалентності відповідає pH>7:
a) HNO3 + NaOH;
б) CH3COOH + NaOH;
в) KOH + HCl;
г) Na2CO3 + HCl?
4. Як впливає константа дисоціації, температура, концентрація розчинів, об’єм розчину, що титрується, швидкість титрування на величину і положення стрибка титрування?
5. Який із індикаторів (метиловий оранжевий, фенолфталеїн, лакмус) можна застосувати для визначення кінця титрування:
а) HCOOH + NaOH;
б) HNO3 + NaOH;
в) CH3NH2 + HCl;
г) KCN + HCl?
6. Який вид індикаторної похибки слід враховувати при титруванні з метиловим оранжевим:
а) CH3COOH + NaOH;
б) HCl + NaOH;
в) Na2CO3 + HCl?
7. Написати формулу для розрахунку титру розчину HCl при титруванні розчину K2HPO4 з метиловим оранжевим.
8. Який склад буферного розчину буде при титруванні розчином NaOH розчину H3PO4 у присутності метилового оранжевого?
9. Як визначити масові частки Na2CO3 і NaHCO3 у суміші при титруванні розчину суміші з фенолфталеїном і метиловим червоним? Навести відповідні розрахункові формули.
10. Який з методів – пряме чи обернене кислотно-основне титрування використовується при визначенні вмісту NH4Cl, NH3·H2O, CaCO3?
11. Як залежить величина стрибка титрування від константи стійкості комплексної сполуки, температури, концентрації і pH середовища?
12. Вивести формули для розрахунків рСа при титруванні розчином ЕДТА (c=0,01моль/дм3) розчину СаСl2 (c(CaCl2)=0,01моль/дм3), якщо речовина, що визначається, відтитрована при pH 10,0 на 99,9; 100,0; 100,1%.
13. Чому комплексонометричне визначення йонів Со2+, Zn2+, Ni2+, Cd2+ проводять у середовищі амоніачного буфера?
14. Чому визначення йонів Fe3+ за допомогою ЕДТА проводять у кислому середовищі?
15. У чому суть роздільного комплексонометричного титрування компонентів суміші з використанням маскуючих речовин:
а) Cu2+, Pb2+ у присутності KCN;
б) Ni2+, Fe3+ у присутності KF;
в) Cu2+, Cd2+ у присутності Na2S2O3?
16. Як залежить величина стрибка титрування від добутку розчинності малорозчинного електроліту, температури і концентрації розчину?
17. У якій послідовності будуть випадати осади при аргентометричному визначенні суміші, що містить йони Cl–, Br–, I– при однаковій молярній концентрації?
18. Вивести формули для розрахунків рСl при титруванні розчином AgNO3 (c(AgNO3) = 0,1 моль/дм3) розчину NaCl (c(NaCl)=0,1моль/дм3), якщо речовина, що визначається, відтитрована на 99,9; 100,0; 100,1%.
19. При титруванні розчину якого галогеніду (NaCl чи NaBr) однакової концентрації, точність тіоціанометричного визначення буде вища?
20. У якому випадку стрибок титрування буде більшим, якщо розчин KBr (c(KBr)=0,1моль/дм3) титрують розчином АgNO3 (c(AgNO3)=0,1моль/дм3), чи розчином Hg2(NO2)2 такої ж концентрації?
21. Які вимоги до окисно-відновних реакцій, що застосовуються в титриметричному аналізі?
22. Визначити молярну масу еквівалента окисника і відновника в реакціях:
а) I2 + 2  " 2I– +
" 2I– +  .
.
б) 5H2C2O4 + 2 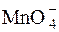 + 6H+ = 2Mn2+ + 10CO2 + 8H2O
+ 6H+ = 2Mn2+ + 10CO2 + 8H2O
в) 3N2H4 + 2  = 3N2 + 2Br̅ + 6H2O.
= 3N2 + 2Br̅ + 6H2O.
23. Як залежить величина стрибка титрування в редокс-методах від концентрації вихідних розчинів, pH розчину, різниці стандартних потенціалів окисника і відновника?
24. Як зміниться величина стрибка у процесі титрування йонів Fe2+, розчином KMnO4 при додаванні у розчин йонів PO43– або F– ?
25. Розчин H2SO3 титрується розчином І2 (c(І2)=0,02моль/дм3) при різних значеннях pH: 0,0 і 3,0. При якому значенні pH стрибок титрування буде більшим?
26. Поясніть, чому реакція 2Cu2+ + 4I– = 2CuI(т) + I2 відбувається зліва направо, а не у зворотному напрямку, як це випливає із стандартних окисно-відновних потенціалів пар Cu2+/Cu+ і I2/2I–.
27. Привести конкретні приклади фіксування точок еквівалентності в методах окиснення-відновлення.
28. Які способи встановлення кінцевої точки титрування в методах окиснення-відновлення найбільш розповсюджені: безіндикаторні, з редокс-індикаторами, із специфічними індикаторами?
29. Величина стрибка титрування становила 0,84…1,02В. Які редокс-індикатори можна застосувати у даному титруванні?
30. Які реакції називаються індукованими? Як пояснюються реакції спряженого окиснення?
31. Які реагенти вводять у розчин, що містить йони Fe2+ і Cl–, перед титруванням перманганатом і для чого?
32. Чому для встановлення титру розчину калій перманганату краще взяти натрій оксалат, ніж щавлеву кислоту?
33. Навести приклади прямого, зворотного перманганатометричного титрування.
34. Які умови (температура, pH розчину, швидкість додавання титранту) необхідно дотримувати при прямому перманганатометричному визначенні відновників?
35. Порівняти переваги і недоліки методів перманганатометрії і хроматометрії.
36. Які умови (температура, pH розчину, тривалість титрування, застосування індикатора) потрібно виконувати при йодометричному титруванні.
37. Чому при визначенні йонів SO32– йодометричним методом переважно застосовують зворотне титрування?
38. Як у йодометрії визначають вміст окисників, відновників? Написати відповідні рівняння реакцій, розрахунки молярних мас еквівалентів речовин, які визначаються.
39. Які індикатори застосовують у методі броматометрії? Який механізм їх дії?
40. Написати рівняння реакцій, що лежать в основі визначення сильних кислот редокс-методом.
Дата добавления: 2015-12-26; просмотров: 4812;
