Приклади розв’язування задач. Приклад 1. Розрахувати розчинність CaSO4 у воді, в розчині KNO3 з молярною концентрацією калій нітрату 0,01моль/дм3 і в розчині Mg(NO3)2 з молярною
Приклад 1. Розрахувати розчинність CaSO4 у воді, в розчині KNO3 з молярною концентрацією калій нітрату 0,01моль/дм3 і в розчині Mg(NO3)2 з молярною концентрацією магній нітрату 0,01моль/дм3.
Дано:
c(KNO3) = 0,01моль/дм3 ДP(CaSO4) =2,37∙10–5
 c(Mg(NO3)2) = 0,01моль/дм3
c(Mg(NO3)2) = 0,01моль/дм3
S (CaSO4) – ?
Розв’язування
Позначимо розчинність CaSO4 у воді через х. Так як CaSO4 при розчиненні дає по одному йону Ca2+ і  ,то
,то
[Ca2+] = [  ] = [CaSO4] = x
] = [CaSO4] = x
ДР(CaSO4) = [Ca2+]·[  ] = x·x = 2,37∙10–5
] = x·x = 2,37∙10–5
x2= 2,37·10–5; x = 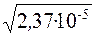 = 4,868·10–3моль/дм3
= 4,868·10–3моль/дм3
Знайдемо розчинність CaSO4 у розчині KNO3 з молярною концентрацією речовини 0,01моль/дм3. Йонна сила розчину буде визначатися концентрацією і зарядами всіх присутніх у розчині йонів:
μ = ½([K+]·12 + [ 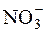 ]·12 + [Ca2+]·22 + [
]·12 + [Ca2+]·22 + [  ]·22) = ½(0,01·12 +
]·22) = ½(0,01·12 +
+ 0,01·12 + 0,004868·22 + 0,004868·22) = ½(0,01 + 0,01 + 0,0195 +
+ 0,0195) = 0,0295
Так як у таблиці немає йонної сили розчину, що дорівнює 0,0295, то величину коефіцієнтів активності 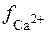 =
= 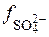 знаходять методом інтерполяції:
знаходять методом інтерполяції:
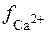 =
= 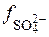 = 0,55–0,018 = 0,532 або приблизно 0,53
= 0,55–0,018 = 0,532 або приблизно 0,53
ДР(CaSO4) = [Ca2+]·[  ]∙
]∙ 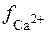 ∙
∙ 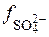 = x∙x∙0,532 = 2,37∙10–5
= x∙x∙0,532 = 2,37∙10–5
x2∙0,532 = 2,37∙10–5
x =  = 9,2∙10–3моль/дм3
= 9,2∙10–3моль/дм3
Знайдемо розчинність СaSO4 у розчині Mg(NO3)2 з молярною концентрацією речовини 0,01моль/дм3.
У цьому випадку йонна сила розчину становить:
μ = ½([Mg2+]∙22 + 2[ 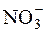 ]·12 + [Ca2+]·22 + [
]·12 + [Ca2+]·22 + [  ]·22) =
]·22) =
= ½(0,01·4 + 2·0,01 + 0,004868·4 + 0,004868·4) = 0,0495 ≈ 0,05
Отже, 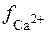 =
= 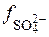 = 0,45.
= 0,45.
ДР(CaSO4) = [Ca2+]∙[  ]∙
]∙ 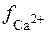 ∙
∙ 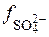 = x∙x∙0,452 = 2,37∙10–5
= x∙x∙0,452 = 2,37∙10–5
x2∙0,452 = 2,37∙10–5
x = 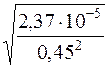 = 1,082∙10–2 моль/дм3
= 1,082∙10–2 моль/дм3
З цих розрахунків випливає, що розчинність кальцій сульфату в розчинні калій нітрату (с=0,01моль/дм3) приблизно в 1,9 рази більша від розчинності у чистій воді, а розчинність CaSO4 у розчині Mg(NO3)2 (с=0,01моль/дм3) приблизно в 2,2 рази більша, ніж у чистій воді.
Приклад 2. Обчислити інтервал значень pH розчину для кількісного розділення йонів Fe3+ і Mg2+ шляхом осадження їх у формі гідроксидів.
Розв’язування
Спочатку розраховується значення pH розчину, при якому буде досягнута повнота осадження йонів Fe3+ у вигляді Fe(OH)3. Критерієм повноти осадження буде [Fe3+ ]£1,0∙10–6 моль/дм3.
Виходячи з добутку розчинності
ДР(Fe(OH)3) = [Fe3+]∙[OH–]3 = 6,3∙10–38,
знаходять концентрацію йонів ОН–, при якій буде досягнута повнота осадження йонів Fe3+:
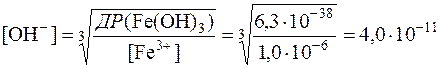 моль/дм3
моль/дм3
Звідси
 моль/дм3
моль/дм3
рH = –lg[H+] = –lg(2,5∙10–4) = 3,6
Отже, для повноти осадження йонів Fe3+ у формі Fe(OH)3 необхідно підтримувати в розчинні pH 3,6.
Йони Mg2+, будуть залишатися в розчинні до тих пір, доки не буде досягнуто добуток розчинності Mg(OH)2, тобто умовою збереження йонів Mg2+ у розчинні буде
[Mg2+]∙[OH–]2 < ДР(Mg(OH)2); ДР(Mg(OH)2) = 6,0∙10–10
Звідси
[OH–]£ 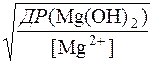 £
£ 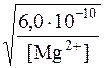 моль/дм3
моль/дм3
Якщо у вихідному розчині [Mg2+]=0,1моль/дм3, то умовою невипадіння в осад Mg(OH)2 буде
[OH–]£ 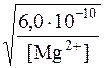 моль/дм3; [OH–]£7,8∙10–5моль/дм3,
моль/дм3; [OH–]£7,8∙10–5моль/дм3,
а якщо [Mg2+]=1,0∙10–2моль/дм3, то
[OH–]£ 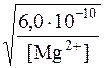 моль/дм3; [OH–]£2,5∙10–4моль/дм3,
моль/дм3; [OH–]£2,5∙10–4моль/дм3,
Якщо концентрація йонів Mg2+ у вихідному розчині становить 0,1моль/дм3, то для збереження цих йонів у розчині [OH–]£7,8∙10–5моль/дм3, що відповідає
[H+]= 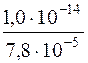 =1,3·10–10моль/дм3, або pH£9,9.
=1,3·10–10моль/дм3, або pH£9,9.
Таким чином, якщо у розчині буде підтримуватися значення pH не менше, ніж 3,6 і не більше, ніж 9,9, то Fe3+ повністю буде в осаді у вигляді Fe(OH)3, а йони Mg2+ повністю залишаться в розчині. Цю умову можна записати у вигляді формули:
3,6£pH£9,9.
Приклад 3.Який об’єм розчину аргентум нітрату з масовою часткою AgNO3 2% необхідно взяти для осадження йонів Cl– із наважки CaCl2∙6H2O масою 0,4382г?
Дано:
m(CaCl2∙6H2O) = 0,4382г
 w(AgNO3) = 2%
w(AgNO3) = 2%
V(AgNO3(p)) – ?
Розв’язування
Обчислення виконуються наближено, тому числа, які беруться для розрахунків, слід округлити.
Визначається маса аргентум нітрату, необхідна для осадження йонів Cl–:
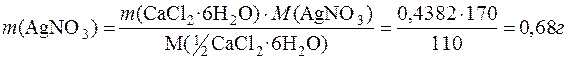
Далі визначається об’єм розчину AgNO3 (w(AgNO3)=2%), у якому міститься розрахована маса AgNO3. Густину розчину можна прийняти за одиницю.
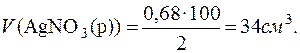
Приклад 4. Обчислити втрату маси і відносну похибку за рахунок розчинності осаду CaC2O4·H2O, якщо до 20см3 розчину CaCl2 з молярною концентрацією речовини CaCl2 0,1моль/дм3 додали 30см3 розчину (NH4)2C2O4 з молярною концентрацією речовини амоній оксалату 0,1моль/дм3.
Дано:
V(CaCl2(p)) = 20см3 ДР(СаС2О4) = 2,3∙10–9
с(CaCl2) = 0,1моль/дм3 М(СаС2О4∙Н2О) = 146,12г/моль
V( (NH4)2C2O4(p)) = 30см3
с( (NH4)2C2O4) = 0,1моль/дм3
 m(CaC2O4·H2O) – ?
m(CaC2O4·H2O) – ?
η – ?
Розв’язування
Після зливання розчинів кальцій хлориду і амоній оксалату об’єм утвореного розчину становить: 20см3+30см3=50см3. Надлишок розчину осаджувача складає 10см3. Концентрація оксалат-іонів у отриманому розчині дорівнює:
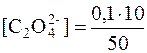 = 0,02моль/дм3
= 0,02моль/дм3
Позначимо через х розчинність СаС2О4∙Н2О. Тоді [Са2+]=х моль/дм3, [ 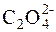 ]=(0,02+х)моль/дм3. Виходячи із значення ДР(СаС2О4),
]=(0,02+х)моль/дм3. Виходячи із значення ДР(СаС2О4),
[Са2+]·[ 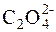 ] = х∙(0,02+х) = 2,3∙10–9
] = х∙(0,02+х) = 2,3∙10–9
Так як х « 0,02, то (0,02+х) ≈ 0,02. Отже, х∙0,02 = 2,3∙10–9. Звідси:
 = 1,15∙10–7моль/дм3
= 1,15∙10–7моль/дм3
Розчинність СаС2О4 дорівнює 1,15∙10–7моль/дм3. Втрати через розчинність кальцій оксалату у розчині об’ємом 50см3 становитимуть:
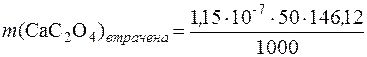 = 8,4∙10–7г.
= 8,4∙10–7г.
Маса осаду СаС2О4∙Н2О, отриманого при зливанні розчинів кальцій хлориду і амоній оксалату становить:
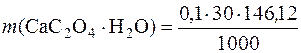 = 0,4383г.
= 0,4383г.
Тоді η = 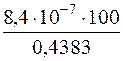 = 1,9·10–4%.
= 1,9·10–4%.
Приклад 5. Обчислити масову частку втрат магній гідроксиду за рахунок розчинності осаду Mg(OH)2 масою 0,2г при промиванні водою об’ємом 250см3. Визначити концентрацію амоніаку у промивній рідині, щоб втрати при промиванні осаду таким же об’ємом склали не більше 0,1%.
Дано:
m(Mg(OH)2) = 0,2г ДР(Mg(OH)2) = 6,0·10–10
V(H2O) = 250см3 M(Mg(OH)2) = 58,32г/моль
 V(NH3(р)) = 250см3 Kд(NH3·H2O) = 1,76·10–5
V(NH3(р)) = 250см3 Kд(NH3·H2O) = 1,76·10–5
w(Mg(OH)2) – ?
с(NH3(p)) – ?
Розв’язування
Виходячи з добутку розчинності Mg(OH)2 визначають концентрацію йонів Mg2+ і рівну їй концентрацію Mg(OH)2 у водному насиченому розчині.
ДР(Mg(OH)2) = [Mg2+]·[OH–]2 = 6,0∙10–10.
Позначимо через х моль/дм3 розчинність Mg(OH)2. Тоді [Mg2+] = х моль/дм3, а [OH–] = 2х моль/дм3. Підставляючи ці значення у формулу добутку розчинності Mg(OH)2, маємо:
х·(2х)2 = 6,0·10–10; 4х3 = 6,0·10–10; х3 = 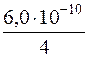 ;
;
х = 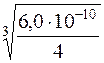 = 5,31·10–4моль/дм3.
= 5,31·10–4моль/дм3.
Отже, втрати при промиванні осаду Mg(OH)2 водою за рахунок розчинності будуть складати:
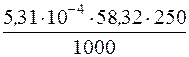 = 7,74·10–3г Mg(OH)2,
= 7,74·10–3г Mg(OH)2,
або  = 3,87%.
= 3,87%.
Якщо промивати осад Mg(OH)2 розчином амоніаку, розчинність магній гідроксиду знижується внаслідок введення однойменних з осадом йонів ОН–. Знаючи, що втрати Mg(OH)2 при промиванні цією промивною рідиною не повинні перевищувати 0,1%, знаходимо розчинність Mg(OH)2 в моль/дм3:
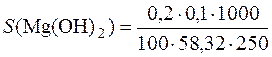 = 1,37·10–5моль/дм3.
= 1,37·10–5моль/дм3.
Отже, [Mg2+] = 1,37·10–5моль/дм3.
Використовуючи значення добутку розчинності Mg(OH)2, визначаємо рівноважну концентрацію ОН–-іонів:
6,0·10–10 = [Mg2+]·[OH–]2 = 1,37·10–5·[OH–]2
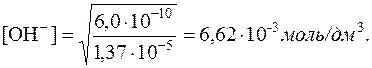
На основі константи дисоціації NH3·H2O
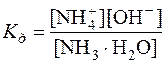
розраховуємо концентрацію NH3 у розчині, у якому [OH–] =
6,62·10–3моль/дм3. Так як у водному розчині амоніаку [ 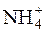 ]=[OH–], то з константи дисоціації виходить:
]=[OH–], то з константи дисоціації виходить:
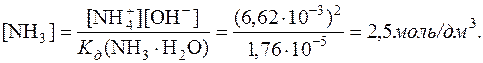
Приклад 6. Після відповідної обробки мінералу, що містить Сульфур, взятого масою 2,6248г було отримано 0,3248г BaSO4. Розрахувати масову частку Сульфуру у досліджуваному мінералі.
Дано:
m(мінералу) = 2,6248г M(S) = 32,06г/моль
m(BaSO4) = 0,3248г M(BaSO4) = 233,39г/моль
 w(S) – ?
w(S) – ?
Розв’язування
Фактор перерахунку (гравіметричний множник):
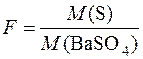 .
.
Тоді:
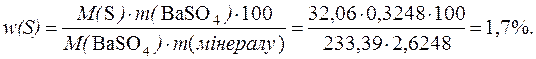
Масова частка Сульфуру у досліджуваному мінералі складає 1,7%.
§ 32. Запитання для самоперевірки
1. Які вимоги ставляться до осаджуваної форми у гравіметричному аналізі?
2. Які вимоги ставляться до гравіметричної форми?
3. Як впливають на повноту осадження BaSO4 температура розчину, концентрація і об’єм розчину осаджувача, наявність сторонніх електролітів?
4. Які йони будуть адсорбуватися на поверхні осаду на початку осадження BaCl2 розчином Na2SO4 і Na2SO4 розчином BaCl2?
5. Які йони будуть адсорбуватися на поверхні осаду при додаванні надлишку осаджувача після осадження BaCl2 розчином Na2SO4 і Na2SO4 розчином BaCl2?
6. Яку сіль – Ba(NО3)2, BaBr2, BaCl2 чи Ba(ClO4)2 – доцільно використати як осаджувач для отримання найбільш чистого осаду BaSO4?
7. Яку сполуку – K2C2O4, Na2C2O4, H2C2O4 чи (NH4)2C2O4 – доцільно використати як осаджувач для осадження йонів Ca2+?
8. У якому випадку втрати при промиванні осаду Fe(OH)3 будуть найменшими: а) при промиванні осаду водою; б) розчином NH4NO3; в) розчином NH4NO3 з NH3?
9. Яка сполука найбільш придатна як гравіметрична форма для кількісного визначення Ca2+, Sr2+, Ni2+, Zn2+, Cu2+?
10. Як зв’язано відносне пересичення розчину з числом центрів кристалізації, швидкістю кристалізації, розміром кристалів?
11. Які процеси відбуваються при дозріванні кристалічних осадів?
12. Чому осадження барій сульфату проводиться з розведених розчинів, у кислому середовищі, при нагріванні розчинів, у присутності солей амонію?
13. Які фізико-хімічні процеси у розчині призводять до співосадження?
14. Які аналітичні заходи застосовуються для зменшення адсорбції і оклюзії при отриманні кристалічних осадів?
15. Які умови осадження аморфних осадів? Чому їх осадження проводять з концентрованих розчинів?
Контрольні задачі
1. Обчислити об’єм розчину натрій гідрофосфату з молярною концентрацією речовини Na2HPO4 0,5 моль/дм3, який треба взяти для осадження йонів Mg2+ у вигляді MgNH4PO4 із 0,5г сплаву, що містить магній масовою часткою 90%, за умови стехіометричного співвідношення реагуючих речовин.
Відповідь: 37,0см3.
2. Обчислити об’єм хлоридної кислоти (ρ=1,17г/см3), який треба взяти для осадження йонів Ag2+ у вигляді AgCl з 2,0г сплаву, що містить срібло масовою часткою 22% за умови використання півторакратної кількості осаджувача.
Відповідь: 0,56см3.
3. Для визначення сірки наважку руди масою 2,0г, що містить 20%S , сплавляють з Na2O2 і сплав розчиняють у 200см3 води. Розрахувати об’єм розчину BaCl2 з молярною концентрацією барій хлориду 0,25моль/дм3, який необхідний для осадження сульфат-іонів у вигляді BaSO4 з 20см3 отриманого розчину за умови півторакратної кількості осаджувача.
Відповідь: 7,5см3.
4. Обчислити масу диметилсульфату (CH3O)2SO2, яка необхідна для осадження йонів Ва2+ з розчину, що містить 0,2г BaCl2·2H2O за умови трикратної кількості осаджувача.
Відповідь: 0,31г.
5. Обчислити втрати PbSO4 (в г і %) за рахунок розчинності осаду, якщо до 20см3 розчину Pb(NO3)2 з молярною концентрацією плюмбум нітрату 0,1моль/дм3 додали півторакратний надлишок розчину сульфатної кислоти з молярною концентрацією H2SO4 0,1моль/дм3.
Відповідь: 1,21·10–5г; 2,0·10–3%.
6. Розрахувати втрати CaCO3 при промиванні 0,3г осаду водою об’ємом 250см3.
Відповідь: 1,54·10–3г.
7. Розрахувати об’єм води, який треба взяти для промивання осаду MgNH4PO4·6H2O масою 0,5г, щоб втрати за рахунок розчинності не перевищували 0,05%.
Відповідь: 16,2см3.
8. Наважку алюмокалієвого галуну масою 2,671г розчинили в 200,0см3 води і з 20,0см3 цього розчину отримали 0,2680г ВаSO4. Обчислити масову частку Алюмінію в препараті.
Відповідь: 5,80%.
9. Із наважки сплаву масою 2,700г отримали 0,2004г Al2O3 і 0,0518г SiO2. Розрахувати масові частки Al і Si у сплаві.
Відповідь: 3,93%; 0,90%.
10. Наважку технічного натрію масою 0,2120г розчинили у 200,0см3 води і з 20,0см3 отриманого розчину отримали 0,5578г NaZn(UO2)3(CH3COO)9·6H2O. Розрахувати масову частку Na2O у досліджуваному зразку.
Відповідь: 53,02%.
11. Наважку сильвініту масою 5,000г розчинили у мірній колбі об’ємом 500см3. З 10,0см3 цього розчину отримали 0,1948г калій тетрафенілборату KB(C6H5)4. Розрахувати масову частку KCl у вологому сильвініті, якщо вміст води у зразку складає 2,50%.
Відповідь: 40,53%.
12. Наважку органічної речовини масою 0,4004г мінералізували і залишок розчинили в колбі об’ємом 200,0см3. З 20,0см3 цього розчину отримали 0,1982г (NH4)3PO4·12MoO3. Розрахувати масову частку Фосфору в досліджуваній речовині.
Відповідь: 8,17%.
13. Для визначення саліцилової кислоти наважку фармацевтичного препарату масою 0,2101г перевели в розчин Na2CO3, додали йод і отримали 0,5175г тетрайодфеніленхінону (C6H2I2O)2. Розрахувати масову частку саліцилової кислоти C6H4(OH)COOH у препараті.
Відповідь: 98,93%.
14. З наважки технічного цинк сульфату масою 1,135г отримали 0,5298г Zn2P2O7 і 0,9052г BaSO4. Розрахувати масові частки ZnSO4 і K2SO4 у технічному продукті.
Відповідь: 49,46%; 6,16%.
15. Із наважки суміші NaCl і KCl масою 0,1225г отримали 0,2850г AgCl. Розрахувати масові частки NaCl і KCl у суміші.
Відповідь: 76,26%; 23,74%.
16. Наважку Fe2O3 і Al2O3 масою 0,7000г відновили воднем і отримали 0,6350г продукту, що містить Fe і Al2O3. Розрахувати масові частки Fe2O3 і Al2O3 у вихідній суміші.
Відповідь: 30,90%; 69,10%.
17. Обчислити об’єм розчину оксихіноліну з масовою часткою C9H6NOH 5% (d=1,07г/см3), який треба взяти для осадження Mg2+ із 20см3 розчину, отриманого при розчиненні 5г доломіту CaCO3·MgCO3 у 200см3 розчину хлоридної кислоти, якщо реагенти беруться в стехіометричних кількостях.
Відповідь: 14,77см3.
18. Обчислити об’єм розчину амоній сульфату з молярною концентрацією (NH4)2SO4, який треба додати до 300см3 води, щоб при промиванні осаду BaSO4 масою 0,5г цим розчином втрати за рахунок розчинності не перевищували 0,01%.
Відповідь: 0,92см3.
19. Розрахувати масову частку Na2S2O3·5H2O у технічному препараті натрій тіосульфату, якщо з наважки препарату масою 0,1852г після окиснення  до
до  отримали осад масою 0,3448г.
отримали осад масою 0,3448г.
Відповідь: 98,98%.
20. Обчислити число молекул води в молекулі залізоамонійного галуну, якщо з наважки галуну масою 0,5020г отримали 0,0891г Fe2O3.
Відповідь: 12.
Дата добавления: 2015-12-26; просмотров: 12090;
