Методы диспергирования.
Диспергирование– тонкое измельчение твердых материалов или жидкостей и распределение их частиц в жидкой или газообразной среде.
В результате образуются порошки, суспензии, аэрозоли, эмульсии.
Механическое диспергирование.
Для получения коллоидных растворов этим методом производится растирание и дробление твердых тел в специальных машинах - шаровых или коллоидных мельницах.
Метод электрического распыления: через какую-либо дисперсионную среду (например, воду) пропускают электрический ток между электродами, изготовленными из материала, коллоидный раствор которого хотят получить. При этом один электрод распыляется в жидкости. Получают коллоидные растворы золота, серебра, платины и других металлов.
Ультразвуковое распыление: ультразвуковые волны с частотой от 20 тысяч до 1 млн. колебаний в секунду получают с помощью пьезоэлектрических осцилляторов. Взвесь грубодисперсного вещества, подлежащего раздроблению, под действием ультразвуковых волн размельчается до коллоидного состояния. Так получают коллоидные растворы смол, гипса, графита, металлов, красителей, крахмала и т.д.
Метод пептизации.
Перевод осадка в золь путем обработки пептизаторами – растворами электролитов, ПАВ или растворителем. При пептизации не происходит изменения степени дисперсности частиц.
Результатом пептизации является разобщение частиц и распределение их по всему объему дисперсионной среды.
Различают два вида пептизации: непосредственная и опосредованная.
Рассмотрим оба вида на примере студенистого осадка гидроксида железа, полученного по реакции
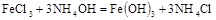
Непосредственная пептизация: действуем раствором 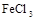 . Ионы железа, адсорбируясь на поверхности частиц, сообщают им положительный заряд, одноименно заряженные частицы отталкиваются и переходят из осадка в раствор:
. Ионы железа, адсорбируясь на поверхности частиц, сообщают им положительный заряд, одноименно заряженные частицы отталкиваются и переходят из осадка в раствор:
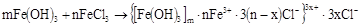
Посредственная пептизация: действуем разбавленной соляной кислотой. Часть молекул  взаимодействует с
взаимодействует с 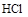 с образованием хлороксида железа
с образованием хлороксида железа 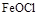 . Ионы вновь полученного пептизатора
. Ионы вновь полученного пептизатора 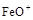 , адсорбируясь на поверхности частиц осадка
, адсорбируясь на поверхности частиц осадка  , переводят его в коллоидное состояние:
, переводят его в коллоидное состояние:
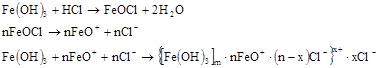
На пептизацию влияют структура осадка, возраст осадка, концентрация пептизатора, механическое воздействие, температура. Свежеосажденные осадки наиболее легко пептизируются, у старых осадков способность к пептизации исчезает. Перемешивание благоприятствует пептизации. С повышением температуры скорость пептизации возрастает.
Строение мицеллы.
Согласно общепринятой мицеллярной теории строения коллоидных растворов, золь состоит из двух частей - мицелл (структурных единиц коллоидных растворов) и интермицеллярной жидкости - дисперсионной среды, разделяющей мицеллы, в которой растворены электролиты, неэлектролиты и ПАВ.
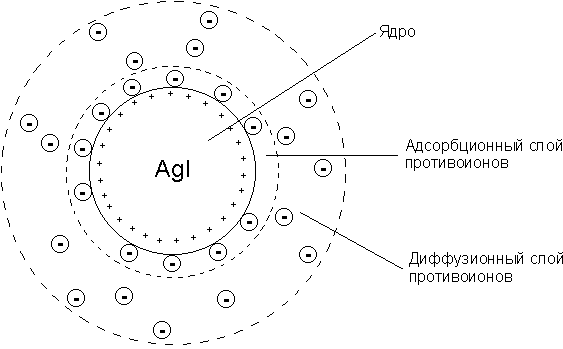
Строение структурной единицы лиофобных коллоидов – мицеллы – может быть показано лишь схематически, поскольку мицелла не имеет определенного состава. Рассмотрим строение коллоидной мицеллы на примере гидрозоля иодида серебра, получаемого взаимодействием разбавленных растворов нитрата серебра и иодида калия:
AgNO3 + KI ––> AgI↓+ KNO3
Коллоидная мицелла золя иодида серебра образована микрокристаллом иодида серебра, который способен к избирательной адсорбции из окружающей среды катионов серебра или иодид-анионов. Если реакция проводится в избытке иодида калия, то ядро будет адсорбировать иодид-анионы; при избытке нитрата серебра микрокристалл адсорбирует ионы Ag+. В результате этого микрокристалл приобретает отрицательный либо положительный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими, а сам заряженный кристалл – ядром мицеллы. Заряженное ядро притягивает из раствора ионы с противоположным зарядом - противоионы; на поверхности раздела фаз образуется двойной электрический слой. Некоторая часть противоионов адсорбируется на поверхности ядра, образуя т.н. адсорбционный слой противоионов; ядро вместе с адсорбированными на нем противоионами называют коллоидной частицей или гранулой. Остальные противоионы, число которых определяется, исходя из правила электронейтральности мицеллы, составляют диффузный слой противоионов; противоионы адсорбционного и диффузного слоев находятся в состоянии динамического равновесия адсорбции – десорбции. Схематически мицелла золя иодида серебра, полученного в избытке иодида калия (потенциалопределяющие ионы – анионы I–, противоионы – ионы К+) может быть изображена следующим образом:{[AgI]m · nI– · (n-x)K+}x– · x K+
При получении золя иодида серебра в избытке нитрата серебра коллоидные частицы будут иметь положительный заряд:{[AgI]m·nAg+·(n-x)NO3–}x+·xNO3–
Схема строения коллоидной мицеллы в случае избытка нитрата серебра приведена ниже.
4.2.3 Коагуляция лиофобных коллоидов
Лиофобные коллоиды являются термодинамически неустойчивыми системами, существующими благодаря стабилизации за счет возникновения двойного электрического слоя. Изменение состояния ДЭС может привести к потере агрегативной устойчивости - слипанию частиц в более крупные агрегаты, т.е. коагуляции золя. Коагуляция золей может быть вызвана различными факторами: прибавлением электролитов, нагреванием или замораживанием, механическим воздействием и т.д. Наиболее важным и изученным фактором коагуляции гидрофобных коллоидов является воздействие на них растворов электролитов.
Для коагуляции золей электролитами установлен ряд эмпирических закономерностей.
1.Для начала коагуляции золя необходима некоторая минимальная концентрация электролита, называемая порогом коагуляции γ.
2. Коагулирующим действием обладает тот из ионов электролита, заряд которого противоположен заряду коллоидных частиц, причем коагулирующее действие иона тем сильнее, чем больше его заряд (правило Шульце - Гарди или правило значности). Величины порогов коагуляции двухзарядных ионов примерно на порядок, а трехзарядных – на два порядка меньше, чем для однозарядных ионов. Правило значности имеет приближенный характер и справедливо только для неорганических ионов; некоторые однозарядные органические ионы обладают более сильным коагулирующим действием, чем двухзарядные неорганические ионы, что обусловлено их сильной специфической адсорбируемостью.
3. В рядах неорганических ионов с одинаковыми зарядами коагулирующее действие возрастает с уменьшением гидратируемости ионов; например, в ряду однозарядных катионов щелочных металлов коагулирующее действие возрастает от лития к рубидию:
γ (Li+) > γ (Na+) > γ (К+) > γ (Rb+)
Ряды, в которые сгруппированы по возрастанию либо по убыванию коагулирующего действия ионы с одинаковым зарядом, называют лиотропными рядами.
4. В осадках, получаемых при коагуляции золей электролитами, всегда присутствуют ионы, вызвавшие коагуляцию.
5. При коагуляции золей смесями электролитов сравнительно редко наблюдается их независимое (аддитивное) действие; обычно имеет место взаимное усиление либо ослабление коагулирующего действия (синергизм либо антагонизм ионов).
Дата добавления: 2015-12-26; просмотров: 1731;
