Принципы классической термодинамики
Термодинамика изучает свойства систем взаимодействующих объектов (тел или полей) путем количественного анализа превращений энергии, происходящих в системе.
Классическая термодинамика сформировалась окончательно в середине XIX века в трудах Клаузиуса и Томсона и представляла собой механическую теорию теплоты.
Со времен античности существовали две точки зрения на природу тепловых явлений. Греки видели в них либо проявление огня, как одного из первичных элементов мира, либо проявление общей идеи теплоты.
В Новое время эти взгляды были представлены в виде теории теплорода, как особых частиц вещества, перетекающих от одного тела к другому, и в виде представления о теплоте, как некоем роде внутреннего движения в веществе. Обе точки зрения формально годились для описания почти всех тепловых явлений. Но ни одна из них не могла претендовать на роль окончательной теории, так как атомно-молекулярная структура вещества оставалась неизученной.
Появление тепловых машин в XVIII-XIX веках потребовало теоретического обоснования их работы. Но только после того, как был определен механический эквивалент теплоты, оказалось возможным построить термодинамику макромира как науку на основе взаимосвязи между тепловой и другими видами энергии без привлечения какой-либо модели структуры вещества.
Основные понятия термодинамики.
Термодинамическая система – мысленно выделенная совокупность макрообъектов, которые обмениваются энергией в форме теплоты или работы друг с другом и с внешней средой.
Изолированная система – такая система, в которой отсутствует обмен энергией и веществом с внешней средой.
Состояние термодинамической системы определяется термодинамическими параметрами.
Термодинамические параметры – физические величины, характеризующие свойства системы в целом (плотность, энергия, вязкость, давление).
Уравнение состояния – связывает термодинамический параметр с параметрами, принятыми за независимые переменные (обычно давление р [Па], объем V [м3], температуру T [К] принимают за независимые переменные).
Равновесное состояние – состояние, параметры которого не изменяются с течением времени при постоянных внешних условиях.
Термодинамический процесс – изменение состояния системы, т.е. изменение значений параметров (например,  или
или 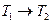 ).
).
Равновесный термодинамический процесс – процесс, который можно рассматривать как непрерывный ряд бесконечно близких равновесных состояний, т.е. параметры – непрерывные функции времени ( 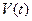 ,
,  и т.д.).
и т.д.).
Обратимый термодинамический процесс – процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы во внешней среде остались какие-либо изменения.
Очевидно, что все реальные тепловые процессы необратимы. Об обратимости можно говорить только в идеальном случае, когда процесс идет настолько медленно, что в каждый момент времени состояние системы является равновесным.
Опыт показывает, что возможна передача энергии системе извне путем теплообмена в форме теплоты и путем силового воздействия в форме механической работы. Математически этот факт опыта обобщен в виде I начала термодинамики:
 ,
,
где  – теплота, переданная системе;
– теплота, переданная системе;
 – работа термодинамической системы;
– работа термодинамической системы;
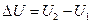 – изменение внутренней энергии системы U;
– изменение внутренней энергии системы U;
С – теплоемкость системы;
V1, T1, U1 – параметры 1-го состояния (до передачи энергии);
V2, T2, U2 – параметры 2-го состояния (после передачи энергии).
Существенно, что, так как 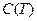 и
и  – функции, характеризующие конкретный процесс,
– функции, характеризующие конкретный процесс, 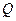 и А зависят от вида процесса, а U не зависит от него и является только функцией состояния.
и А зависят от вида процесса, а U не зависит от него и является только функцией состояния.
Опыт показывает, что все реальные термодинамические процессы необратимы, в то время как равенство  показывает, что равновероятны оба превращения форм энергии. Первоначально этот факт необратимости был обобщен из практики работы тепловых машин в виде II начала термодинамики. Вот две формулировки этого закона:
показывает, что равновероятны оба превращения форм энергии. Первоначально этот факт необратимости был обобщен из практики работы тепловых машин в виде II начала термодинамики. Вот две формулировки этого закона:
1) Клаузиус (1850): невозможен процесс, единственным результатом которого является совершение работы, эквивалентной количеству теплоты, полученному от нагревателя.
2) Томсон (1851): невозможен процесс, единственным результатом которого является передача теплоты от холодного тела к горячему.
Математическое выражение II начала было дано Клаузиусом в виде:  для любого процесса в изолированной системе.
для любого процесса в изолированной системе.
Здесь S – энтропия (превращение) – функция состояния, такая, что для любого обратимого процесса 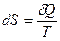 , где
, где 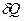 – малое количество теплоты; тогда
– малое количество теплоты; тогда  для любого необратимого процесса.
для любого необратимого процесса.
Очевидно, что для изолированной системы  .
.
Таким образом, была предложена еще одна формулировка II начала термодинамики:
3) Клаузиус (1865): энтропия изолированной системы не может убывать при любых процессах в ней.
Экспериментальное изучение свойств тел при 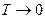 показало, что
показало, что 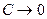
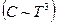 и что практически все вещества кристаллизуются в твердое состояние. Эти факты обобщены в виде III начала термодинамики. Вот две формулировки этого закона:
и что практически все вещества кристаллизуются в твердое состояние. Эти факты обобщены в виде III начала термодинамики. Вот две формулировки этого закона:
1) Постулат Планка (1911): Энтропия правильно сформированного кристалла чистого вещества 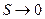 при
при 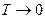 .
.
Учитывая, что 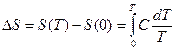 , можно однозначно определить
, можно однозначно определить 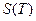 .
.
2) Теорема Нернста (1906): Никакие реальные процессы не способны в принципе обеспечить достижение абсолютного нуля температур.
Действительно, т.к. 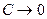 , то и
, то и 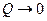 , что технически неосуществимо.
, что технически неосуществимо.
Таким образом, классическая термодинамика основана на трех началах, законах, обобщающих опытные факты; следствия их применения к конкретным системам дают практически значимые результаты.
Дата добавления: 2015-12-26; просмотров: 2251;
