Принцип сохранения энергии
Слово энергия происходит от индоевропейского корня uerg:
 Werk (нем.)
Werk (нем.)
 uerg Work (англ.) дело, творение, работа
uerg Work (англ.) дело, творение, работа

 εργον (греч.)
εργον (греч.)
 ενέργεια
ενέργεια
эрг – эргон – энéргейя
Поскольку древние греки связывали сущность любого явления с чем-то неизменным в нем, с идеей, то и под эргоном они понимали вещь в смысле ее полного осуществления, вещь, ставшую наличной. Следовательно, энéргейя – это действие, которое полностью осуществляет эту вещь, выводит ее в наличное бытие.
У Аристотеля мера действия – тоже не столько работа или продукт действия, сколько приближение к полноте осуществления. Поэтому, энéргейя – это завершение осуществления формы-сущности какой-либо вещи. Кроме понятия энéргейи он вводит также понятие дюнамис (δύναμις) – сил, способных к такому осуществлению.
Римляне понимали эргон уже как результат действия (actio), а энергию как действительность (actus), достигнутую вследствие действия соответствующей причины (causa). Causa → actus. Таким образом, между причиной и следствием устанавливается временная связь.
В схоластике Средних веков дюнамис и энéргейю Аристотеля свели к категориям возможности (potentia) и действительности (actus). Действительность – это то, что наступает в порядке следствия в результате действия причины и требует определенного усилия или работы. Поэтому, энергия стала пониматься как деятельная сила, активность.
В естествознании XVI-XVII веков соотношение причины и следствия уже выступает в качестве теоретического принципа. Лейбниц трактует его следующим образом:
Равные действия должны иметь равные причины. Мир Лейбница состоит из монад –
духовных элементов, каждый из которых имеет внутреннюю деятельную силу. Так как в действии разных сил мы часто можем увидеть один и тот же результат, то должна быть общая мера сил. В случае механического движения это величина  , где
, где 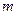 – масса тела,
– масса тела, 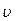 – его скорость. Лейбниц даже предположил, что
– его скорость. Лейбниц даже предположил, что 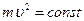 .
.
Позже, в 1807 году, Юнг назвал эту величину энергией. В самом деле, 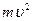 может быть мерой действия силы, если это действие охарактеризовать работой:
может быть мерой действия силы, если это действие охарактеризовать работой:
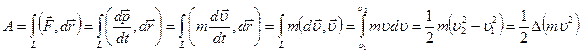 .
.
Работа силы дается изменением величины  .
.
Дальнейшие наблюдения за реальными движениями тел показали, что:
1)  изменяется и учитывает только энергию движения, поэтому величина
изменяется и учитывает только энергию движения, поэтому величина  была названа кинетической энергией. Она определена с точностью до постоянного слагаемого
была названа кинетической энергией. Она определена с точностью до постоянного слагаемого 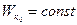 , которое находится из условий конкретной задачи. Таким образом, работа силы равна изменению кинетической энергии тела
, которое находится из условий конкретной задачи. Таким образом, работа силы равна изменению кинетической энергии тела 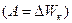 ;
;
2) для консервативных сил, работа которых не зависит от формы траектории, целесообразно ввести понятие потенциальной энергии 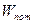 , зависящей только от положения тела, так что
, зависящей только от положения тела, так что  . Тогда полная механическая энергия будет сохраняться, т.е.
. Тогда полная механическая энергия будет сохраняться, т.е. 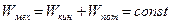 . Действительно,
. Действительно,  .
.
3) Силы трения или сопротивления движению приводят к уменьшению 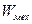 , и закон сохранения механической энергии имеет ограниченное применение.
, и закон сохранения механической энергии имеет ограниченное применение.
В 1840-х годах обратили внимание на превращение различных форм движения в теплоту. Майер выдвинул идею поиска эквивалентов, т.е. количественных соотношений между явлениями природы. Так как причина равна действию, то следствие возникает за счет определенной затраты причины, которую можно выразить в числах. Майер вычислил механический эквивалент теплоты (1 кал ≈ 4,2 Дж) следующим образом:
Пусть 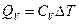 – теплота, переданная газу при
– теплота, переданная газу при  ; в этом процессе механическая работа газа
; в этом процессе механическая работа газа  . Пусть далее
. Пусть далее 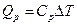 – теплота, переданная этому же газу при
– теплота, переданная этому же газу при  ; работа его расширения в этом процессе
; работа его расширения в этом процессе 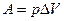 . Следовательно, часть теплоты,
. Следовательно, часть теплоты, 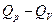 , превращается в механическую работу:
, превращается в механическую работу: 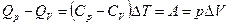 , где
, где 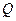 измеряется в калориях (кал), а А – в джоулях (Дж).
измеряется в калориях (кал), а А – в джоулях (Дж).
Имея данные о 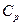 и
и 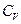 , можно вычислить эквивалент. Джоуль определил его экспериментально, измеряя изменение температуры
, можно вычислить эквивалент. Джоуль определил его экспериментально, измеряя изменение температуры  вследствие действия трения при движении тела.
вследствие действия трения при движении тела.
Джоуль и Ленц измерили электрический эквивалент теплоты (0,24 кал = 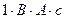 ), используя установленный ими закон: теплота, выделенная электрическим током,
), используя установленный ими закон: теплота, выделенная электрическим током, 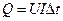 , где U – напряжение, I – сила тока,
, где U – напряжение, I – сила тока, 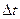 – время.
– время.
Гесс установил принцип, согласно которому тепловой эффект химической реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий.
Например, получение Na2SO4 из H2SO4 и NaOH (в растворе) может быть осуществлено в процессе, имеющем одну стадию:
2 NaOH + H2SO4 = Na2SO4 + 2 H2O + 131,4 кДж;
или же в двухстадийном процессе:
а) NaOH + H2SO4 = NaHSO4 + H2O + 61,7 кДж,
б) NaHSO4 + NaOH = Na2SO4 + H2O + 69,7 кДж.
Как видно, суммарный тепловой эффект двухстадийного процесса оказывается таким же, как и тепловой эффект одностадийного.
После того, как в науке утвердилось представление о теплоте как беспорядочном и непрерывном движении атомов и молекул, закон сохранения энергии приобрел статус общефизического принципа:
Энергия не возникает из ничего и не уничтожается бесследно, различные ее
виды могут превращаться друг в друга в строго эквивалентных отношениях.
Таким образом, энергия есть общая мера различных форм движения и соответствующих им взаимодействий. Вводя механическую, тепловую, электрическую, ядерную и т.д. энергию, можно изучать как известные, так и новые явления природы.
Пример. Взаимосвязь массы и энергии в релятивистской механике.
Выражение для релятивистской массы допускает разложение в ряд:
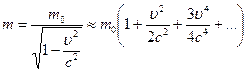 , причем если
, причем если 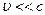 , можно ограничиться только двумя первыми слагаемыми. Здесь
, можно ограничиться только двумя первыми слагаемыми. Здесь 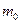 – масса покоя тела,
– масса покоя тела, 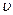 – его скорость, с – скорость света в вакууме.
– его скорость, с – скорость света в вакууме.
Тогда 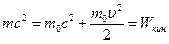 ; где
; где 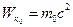 – энергия покоя.
– энергия покоя.
Если тело изолировано, то его полная энергия 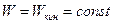 ; принцип относительности требует, чтобы этот закон выполнялся во всех системах отсчета, т.е. и при
; принцип относительности требует, чтобы этот закон выполнялся во всех системах отсчета, т.е. и при 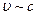 ; тогда
; тогда 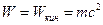 . Такой же результат получается и для других видов энергии, поэтому между массой и энергией существует универсальное соотношение:
. Такой же результат получается и для других видов энергии, поэтому между массой и энергией существует универсальное соотношение:
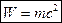 – формула Эйнштейна.
– формула Эйнштейна.
Статистическое истолкование
II начала термодинамики
Классическая термодинамика изучает объекты макромира без рассмотрения их атомно-молекулярной структуры. Но так как эти объекты на самом деле состоят из множества структурных элементов (в 1 моле – 6,02∙1023), то их можно считать системами большого числа частиц и применять к ним методы математической статистики.
Классический вариант статистического подхода в физике сложился во второй половине XIX века в работах Максвелла, Больцмана и Гиббса. Этот подход заключается в том, что характеристики движения отдельных частиц усредняются и связываются с термодинамическими параметрами системы как целого.
Первоначально этот подход опирался на молекулярно-кинетическую теорию вещества. Согласно этой теории все тела состоят из атомов, молекул и ионов, находящихся в непрерывном хаотическом движении. Это механическое движение было названо тепловым, так как объясняло наблюдаемые тепловые явления.
Наиболее простой и удобной теоретической моделью оказался идеальный газ. По-существу, это система материальных точек-молекул, участвующих в тепловом движении. В состоянии термодинамического равновесия и отсутствия внешнего поля все направления движения равновероятны и скорости молекул могут иметь любые значения от 0 до ∞.
В 1860 году Максвелл теоретически показал, что в этом случае в результате столкновений (теплового движения) в идеальном газе устанавливается стационарное распределение молекул по скоростям в виде:
 , где
, где 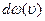 – вероятность того, что модуль скорости любой молекулы заключен в интервале
– вероятность того, что модуль скорости любой молекулы заключен в интервале 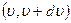 ,
,
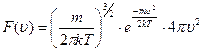 – функция распределения Максвелла, m – масса молекулы, Т – температура, k – постоянная Больцмана.
– функция распределения Максвелла, m – масса молекулы, Т – температура, k – постоянная Больцмана.
Тогда для конечного интервала  вероятность равна:
вероятность равна:
 .
.
Очевидно, что не все значения скоростей равновероятны (так как 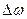 будут различны для одного и того же
будут различны для одного и того же 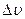 ).
).
Большинство молекул будут иметь скорости в средней части графика  , вблизи
, вблизи  – наиболее вероятной скорости (значение
– наиболее вероятной скорости (значение 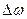 при этом будет максимальным).
при этом будет максимальным).
Средняя арифметическая скорость 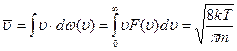 – связана с термодинамическим параметром Т.
– связана с термодинамическим параметром Т.
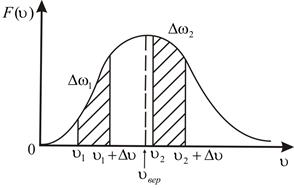
Рисунок 9
Таким образом, даже в такой простой модели идеального газа характеристики движения отдельной частицы несущественны. Одно и то же состояние системы, определяемое термодинамическим параметром Т, может осуществляться множеством способов распределения отдельных частиц по скоростям теплового движения. Частицы могут иметь любые значения  , однако
, однако 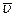 – средняя скорость будет иметь одно определенное значение, связанное с Т. Очевидно также, что более вероятно такое состояние системы, которое осуществляется бóльшим числом способов, и процесс перехода в него будет более вероятен.
– средняя скорость будет иметь одно определенное значение, связанное с Т. Очевидно также, что более вероятно такое состояние системы, которое осуществляется бóльшим числом способов, и процесс перехода в него будет более вероятен.
Пример. При упорядоченном движении тела энергия системы его молекул W распределена между ними малым числом способов, так как бóльшая ее часть сконцентрирована в виде энергии кинетической  , т.е.
, т.е.  , где
, где 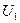 – внутренняя энергия теплового движения.
– внутренняя энергия теплового движения.
После остановки тела в результате действия силы трения, 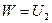 , причем
, причем 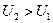 , молекулы движутся теперь неупорядоченно, и поэтому энергия распределяется между ними бóльшим числом способов. Следовательно, переход механической энергии в теплоту более вероятен, чем обратный переход.
, молекулы движутся теперь неупорядоченно, и поэтому энергия распределяется между ними бóльшим числом способов. Следовательно, переход механической энергии в теплоту более вероятен, чем обратный переход.
Итак, необратимость тепловых процессов имеет вероятностный характер. Больцман (1872 г.) предложил связать энтропию и вероятность. Впоследствии была установлена формула 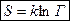 , где Г – термодинамическая вероятность состояния системы, т.е. число способов распределения частиц, осуществляющих данное состояние. Тогда, если процесс обратим, то все состояния равновероятны и
, где Г – термодинамическая вероятность состояния системы, т.е. число способов распределения частиц, осуществляющих данное состояние. Тогда, если процесс обратим, то все состояния равновероятны и 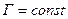 ,
, 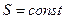 , а если необратим, то Г ↑ и S ↑ => для изолированной системы
, а если необратим, то Г ↑ и S ↑ => для изолированной системы  .
.
Таким образом, статистическое истолкование II начала термодинамики заключается в том, что термодинамическая вероятность состояния изолированной системы не может уменьшаться при любых процессах в ней.
Следствия статистического истолкования.
1) Границы применимости II начала. В случае малого числа частиц в системе II начало становится неприменимым, так как термодинамические вероятности состояний становятся практически равными, и хаотичность теплового движения может вызвать обратимость процесса.
Пример. Две частицы в объеме, разделенном проницаемой перегородкой на две части I и II. Частицы могут свободно переходить из одной части в другую. Возможны три состояния такой системы:
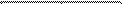 1) Г1 = 2
1) Г1 = 2
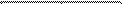 2) Г2 = 1
2) Г2 = 1
 3) Г3 = 1
3) Г3 = 1
I II
Г1 > Г2 , Г3 , значит, более вероятен процесс 2) → 1) или 3) → 1). Однако, как показывает опыт, за большой промежуток времени  среднее число частиц в I части NI будет отличаться от 1. Следовательно, вероятны также процессы 1) → 2) и 1) → 3), что означает нарушение II начала.
среднее число частиц в I части NI будет отличаться от 1. Следовательно, вероятны также процессы 1) → 2) и 1) → 3), что означает нарушение II начала.
2) «Тепловая смерть» Вселенной. Распространение II начала на всю Вселенную, как это сделал Клаузиус, приводит к выводу о переходе всех видов энергии в тепловую и равномерном ее распределении по веществу. При этом 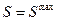 . Прекратятся все процессы, кроме теплового движения, и наступит тепловое равновесие. Однако нет оснований считать Вселенную изолированной термодинамической системой. Поэтому II начало, по-видимому, неприменимо к системам с бесконечным числом частиц.
. Прекратятся все процессы, кроме теплового движения, и наступит тепловое равновесие. Однако нет оснований считать Вселенную изолированной термодинамической системой. Поэтому II начало, по-видимому, неприменимо к системам с бесконечным числом частиц.
3) Поскольку время выражает порядок следования явлений, то факт их необратимости в макромире позволяет обосновать факт необратимости времени. Таким образом, классическая физика подтверждает устойчивость окружающего мира.
Дата добавления: 2015-12-26; просмотров: 1002;
