Физиологические эффекты катехоламинов в зависимости от типа адренорецепторов
| Органы и ткани | Рецептор (тип) | Эффект |
| Сердце (миокард) | Бета-1 | Увеличивают силу сердечных сокращений со сокращения |
| Бета-2 | Увеличивают частоту сокращений сердца | |
| Кровеносные сосуды | Альфа | Вазоконстрикция |
| Бета-2 | Вазодилатация | |
| Почки | Бета | Увеличивают секрецию ренина |
| Панкреас | Альфа | Уменьшают секрецию инсулина и глюкагона |
| Бета | Увеличивают секрецию инсулина и глюкагона | |
| Печень | Альфа, бета | Увеличивают глюкогенолиз |
| Жировая ткань | Бета (-1, -2, -3) | Увеличивают липолиз |
| Метаболизм в тканях | Бета | Увеличивают калоригенез |
| Кожа (потовые железы) | Альфа | Увеличивают потоотделение |
| Бронхи и бронхиолы | Бета-2 | Стимулируют дилатацию |
| Матка | Альфа | Увеличивают сократимость |
| Бета-2 | Релаксация | |
| Кишечник и мочевой | Бета-2 | Увеличивают релаксацию и усиливают |
| пузырь | сфинктеры |
Относительно медленно развивающиеся β-эффекты сводятся к регуляции сердечной деятельности, метаболизма, расширению бронхов, расширению некоторых групп сосудов (например, скелетных мышц, гипергликемии, торможению перистальтики ЖКТ). Через β-адренорецепторы действует, в основном, адреналин, менее норадреналин.
α-адренэргические эффекты обоих катехоламинов избирательно снимаются α-адреноблокаторами (фентоламин, тропафен и т.д.).
β-адреноэргические – специальными β-адреноблокаторами (пропрапонол, альпренолол и т.д.).
В настоящее время различают α1- и α2-адренорецепторы и β1- и β2-адренорецепторы.
Таким образом, катехоламины оказывают неодинаковое действие, что зависит от типа рецептора, скоторым они взаимодействуют. При его взаимодействии с α-и β-адренорецепторами развиваются противоположные результаты. При взаимодействии с α-рецепторами открываются неэлектрические кальциевые каналы, Са++ входит в клетку, реагирует с кальмодулином, активируются контрактильные белки, что ведет к спазму сосуда. При взаимодействии с β-рецептором – гормон действует через аденилатциклазную систему → увеличивается концентрация цАМФ → активация протеинкиназы → активация Са++-насоса → выделение Са++ из клетки → уменьшение концентрации Са++ в цитоплазме → расслабление мышцы. Конечный эффект действия норэпинефрина на клетку будет зависеть от числа α- или β-адренорецепторов на клетке.
Таким образом, при возбуждении α- и β-адренорецепторов используются различные системы посредников (рис. 5.1.6).

Рис.5.1.6. Противоположное влияние адреналина через α- и β-рецепторы на концентрацию кальция в цитозоле гладких мышечных клеток кровеносных сосудов.
Связывание с α-рецепторами приводит к открытию кальциевых каналов мембраны и поступлению кальция в клетку. Взаимодействие с β-рецепторами через систему цАМФ стимулирует активный транспорт, который перемещает кальций из клетки, в результате чего его концентрация в цитозоле падает. Взаимодействие с α-рецептором приводит к активации аденилатциклазной системы и усилению выведения Са2+ из клетки.
Гипергликемический эффект, т.е. усиленный выход глюкозы из печени обеспечивается следующим путем: гормон-рецепторные комплексы активируют аденилатциклазу гепатоцитов; активированная аденилатциклаза стимулирует гидролиз АТФ с образованием цАМФ, концентрация которого максимально увеличивается уже через несколько минут после инъекции гормона; образовавшийся цАМФ активирует протеинкиназу; активированная протеинкиназа обусловливает фосфорилирование киназы гликоген-фосфорилазы b и тем самым переводит ее в более активное состояние; фосфорилированная же киназа обеспечивает переход гликоген-фосфорилазы b в более активную форму фосфорилазы – a – ключевого фермента распада гликогена; последний ускоряет фосфоролиз гликогена и приводит в итоге к увеличенному образованию глюкозы.
Плотность аденорецепторов изменяется при изменении их стимуляции, заболеваниях (гипертиреоз – увеличение β-адренорецепторов на 50-100%, гипотиреоз – их уменьшение).
Физиологическое действие катехоламинов
Адреналин и норадреналин на одни органы-мишени действует сходным образом, а на другие – по-разному.
Как и в случае других гормонов, действие норадреналина и адреналина опосредуется специфичными участками связывания гормона (рецепторами)клеточных мембран органов-мишеней.
Сердце. Адреналин и норадреналин оказывают положительное хронотропное и инотропное действие на изолированное сердце. Он увеличивает и возбудимость миокарда, облегчая тем самым возникновение фибрилляции. Винтактном организме, однако, выявляются различия в действии этих двух гормонов. Введение норадреналина в этом случае не повышает частоты сокращений сердца, а снижает ее (брадикардия); этот эффект относят за счет рефлекторного возбуждения блуждающего нерва, так как он снимается введением атропина.
Артериальное давление. Повышение концентрации норадреналина в крови сопровождается повышением систолического и диастолического давления.Адреналин повышает систолическое артериальное давление, тогда как диастолическое давление остается на постоянном уровне или снижается.
Кровообращение. Во всех отделах сосудистой системы(за исключением сосудов головного мозга) норадреналин вызывает возбуждение гладкомышечной ткани и, следовательно, сужение сосудов. Он вызывает менее выраженное сокращение кожных сосудов, но более мощное общее вазоконстрикторное действие. Потому его прессорный эффект на 50% больше, чем адреналина. Адреналин приводит к сужению некоторых сосудов, в частности сосудов кожи и конечностей при расширении сосудов скелетной мускулатуры, внутренних органов, коронарных, легочных сосудов.
Дыхание. Норадреналин и адреналин увеличивают глубину дыхания; расслабление мускулатуры бронхов снижает сопротивление воздухоносных путей. Благодаря этому эффекту катехоламины и симпатомиметические средства используются для лечения бронхиальной астмы.
Гладкомышечная ткань в других органах. Как правило, адреналин и норадреналин оказывают тормозное влияние на гладкие мышцы желудочно-кишечного тракта, однако оба гормона оказывают возбуждающее действие на гладкую мускулатуру капсулы селезенки, кожные мышцы, поднимающие волос, мигательную перепонку кошки и мышцы радужной оболочки, расширяющие зрачок.
Обмен углеводов. Адреналин вызывает повышение уровня глюкозы в крови в результате распада гликогена в печени; эффект повышения уровня сахара в крови, вызываемый норадреналином, выражен слабо. Благодаря гликогенолитическому действию адреналин является наиболее важным антагонистом инсулина в системе регуляции уровня глюкозы в крови (рис. 5.1.7).
В печень
 Запасы гликогена
Запасы гликогена

Гексозофосфаты
ПеченьМышца
 Глюкоза Молочная кислота
Глюкоза Молочная кислота
Рис. 5.1.7. Цикл Кори.
Обмен жиров. Адреналин и норадреналин обладают липолитическим действием, что приводит к повышению содержания свободных жирных кислот в плазме. Последние используются, например, в качестве субстратов термогенеза при холодовом стрессе.
Энергетический обмен. Основной обмен у взрослого человека увеличивается приблизительно на 30% под влиянием адреналина. Значительно большее увеличение (до 300%) обнаруживают у новорожденных и у адаптированных к холоду организмов, располагающих бурой жировой тканью. Этот термогенный эффектвызывается как норадреналином, так и опосредуется β-адренорецепторами.
Центральная нервная система. Адреналин (в отличие от норадреналина, не обладающего этим действием или дающего лишь очень слабый эффект) стимулирует восходящую ретикулярную формацию(«реакция активации»), что проявляется десинхронизацией ЭЭГ. Возбуждением ЦНС на уровне нервных центров сопровождаются усилением внимания, а в наиболее выраженных случаях – умственным возбуждением и состоянием тревоги.
Таким образом, физиологические эффекты адреналина и норадреналина во многом идентичны активации симпатической нервной системы. Поэтому адреналин и норадреналин надпочечников называют жидкой симпатической нервной системой. Так как практически все клетки организма содержат α-и β-адренорецепторы, в том числе клетки крови – эритроциты, лимфоциты, то степень влияния адреналина и норадреналина как гормонов (в отличие от симпатической нервной системы) намного шире. Совокупность симпатической нервной системы и хромаффинных клеток образует симпатоадреналовую систему.
Терапевтическое применение катехоламинов
Разновидность эффектов, вызываемых адреналином, обусловила его широкое применение в клинической практике. Добавление адреналина к растворам местных или спинальных анестетических средств позволяет производить операции с меньшей кровопотерей, поддерживает высокую концентрацию этих веществ в области операционного поля и препятствует появлению токсических эффектов, связанных с всасыванием анестетиков. Стимулирующее влияние адреналина на сердце делает его ценным аналептиком. Его введение прямо в миокард в ряде случаев восстанавливает сердечную деятельность.
Адреналин применяют для борьбы с гипогликемией, вызванной передозировкой инсулина. Однако если печень бедна гликогеном, использование адреналина с указанной целью неэффективна.
Норадреналин применяется главным образом для лечения коллапса, что обусловлено его сильным общим вазоконстрикторным действием, не сопровождающимся сужением коронарных артерий, или увеличением минутного объема сердца.
Большие дозы адреналина вызывают резчайшие патологические изменения, которые могут закончиться смертью. Первый период, характеризующийся возбуждением с учащением пульса и дыхания, сменяется депрессией. Мышечные движения становятся замедленными, развиваются паралич конечностей и диспноэ. Смерть наступает в результате судорог и отека легких, вызывающих асфиксию. Параличи имеют центральное происхождение.
Заболевание мозгового слоя надпочечников
Феохромоцитома – опухоль, которая развивается из хромаффинных клеток мозгового слоя надпочечника. Кроме надпочечников, такая опухоль может образовываться в симпатических узлах и параганглиях. Эта опухоль обладает способностью секретировать в кровь избыточные количества адреналина и норадреналина. В очень редких случаях феохромоцитома может синтезировать и секретироватьтолько дофамин. Свыше 95% феохромоцитом находятся в брюшной полости, и 90% из них локализуютсяв мозговом слое надпочечников (80% в одном и 10% в обоих). В 10% случаев феохромоцитома имеет вненадпочечниковую локализацию: в стенке мочевого пузыря и органе Цукеркандла. Феохромоцитома относится к редким заболеваниям и среди больных артериальной гипертензией встречается в 0,1% случаев. Она может возникнуть в любом возрасте, но чаще от 30 до 50 лет, с одинаковой частотой у обоих полов. Хотя феохромоцитома встречается редко, она представляет серьезную проблему в своевременном ее выявлении.
КОРА НАДПОЧЕЧНИКОВ
Кора надпочечников состоит из трех слоев (зон): клубочковой, пучковой и сетчатой (рис. 5.2.1). Клубочковая зона в виде узкого наружного слоя расположена под капсулой надпочечника. Клетки этого слоя соединены между собой в виде клубочков. Пучковая зона является самым большим слоем коры, и его клетки располагаются в виде пучков. Сетчатая зона окружает мозговой слой надпочечника, и ее клетки располагаются в виде сетки.
В коре надпочечников синтезируются три группы гормонов. В клубочковой зоне синтезируются минералокортикоиды, главным представителем которых является альдостерон. В пучковой и сетчатой зонах синтезируются глюкокортикоиды, главным представителем которых является кортизол, и надпочечниковые андрогены.
Химическая природа гормонов. По своей химической природе гормоны коры надпочечников являются стероидными гормонами. Это очень важная группа биологически активных веществ. Они представляют собой производные холестерина – кортизол, альдостерон, мужские и женские половые гормоны. Для всех этих гормонов характерна гидрофобность. Поэтому они хорошо проходят из мест своего синтеза через клеточную мембрану и попадают беспрепятственно в другие среды (кровь, межклеточное пространство). В крови они требуют специальных носителей, так как гидрофобны.
Транспорт глюкокортикоидов
Кортизол и надпочечниковые андрогены секретируются в кровь в свободном состоянии, однако, сразу же связываются белками сыворотки крови. Большая часть кортизола связана с кортизолсвязывающим глобулином или транскортином. С ним связано 75-80% кортизола и с альбумином – 15%. В норме в транскортине содержится 700 нмоль/л (25 мкг/дл) кортизола. При гиперсекреции кортизола увеличивается общий кортизол (за счет связанного и за счет свободного). Общий кортизол в сыворотке может увеличиваться при избытке эстрогенов (беременность, лечение эстрогенами, прием контрацептивов), тиреотоксикозе, диабете, но только за счет связанного с белком. Свободный кортизол не увеличивается. Это связано с тем, что эти состояния увеличивают синтез транскортина в печени и связывание им кортизола.
Большинство синтетических аналогов кортизола находится в меньшей связи с белком, чем кортизол. Это объясняет тот факт, что они в значительно меньших дозах и быстрее чем кортизол могут привести к проявлениям, подобным синдрому Кушинга как побочных эффектов лечения.
Механизм действия кортикостероидов
Кортизол, как и другие стероидные гормоны, свободно проходит через клеточные мембраны в клетки, где соединяется с соответствующим для него внутриклеточным рецептором. Далее в ядре клетки они связываются с определенной ДНК (геномом) и активируют ее. В результате увеличивается образование мРНК, которая стимулирует в клетке синтез белковых медиаторов ответа, специфических для каждого гормона.
Физиологические эффекты глюкокортикоидов
К глюкокортикоидным гормонам относятся кортизол, кортизон, кортикостерон, 11-дезоксикортизол, 11-дегидрокортикостерон. У человека наиболее важным глюкокортикоидом является кортизол, который секретируется со скоростью 20-25 мг/сут, и концентрация его в течение суток колеблется от 4 до 16 мкГ%.
Физиологические эффекты глюкокортикоидов весьма разнообразны, они прямо или опосредованно регулируют практически все физиологические и биохимические процессы. Часть из них представляют собой полезный для организма эффект, позволяющий организму выживать в условиях критических ситуаций. Часть эффектов глюкокортикоидов является своеобразной платой за спасение.
Итак:
1.  Глюкокортикоиды участвуют в регуляции углеводного обмена, вызывают повышение содержания в крови глюкозы (поэтому – соответствующее название). Это повышение происходит за счет того, что гормоны вызывают активацию глюконеогенеза – образование глюкозы из аминокислот и жирных кислот (рис. 5.2.1).
Глюкокортикоиды участвуют в регуляции углеводного обмена, вызывают повышение содержания в крови глюкозы (поэтому – соответствующее название). Это повышение происходит за счет того, что гормоны вызывают активацию глюконеогенеза – образование глюкозы из аминокислот и жирных кислот (рис. 5.2.1).
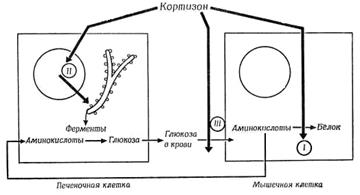
2. Глюкокортикоиды изменяют белковый обмен: углеводный обмен – гипергликемия, глюконеогенез, подавление транспорта глюкозы в мышечной и жировой ткани, подавление гликолиза и гликолитических ферментов, компенсаторная гиперинсулинемия при гипергликемии, синтез гликогена; белковый обмен – катаболический эффект: катаболизм белков мышечной, эпителиальной и лимфоидной тканей, поступление аминокислот в кровь и печень, повышение образования мочевины и экскреции азота, отрицательный азотистый баланс; анаболический эффект: синтез ферментов и некоторых белков в печени; антианаболический эффект: подавление синтеза белков de novo в печени на уровне трансляции.
Одновременно в других органах и тканях, в частности, в скелетных мышцах глюкокортикоиды тормозят синтез белков для того, что бы создать депо аминокислот, необходимых для глюконеогенеза.
Изменяют липидный обмен: липолитический эффект в тканях, гиперлипидемия и гиперхолестеринемия, активация кетогенеза в печени, угнетение липогенеза в печени, стимуляция липогенеза и перераспределения жира в жировой ткани центральной оси туловища и лица, стимуляция аппетита и потребления жира.
3. Глюкокортикоиды вызывают активацию липолиза для появления еще одного источника энергии – жирных кислот.
Итак, главный эффект глюкокортикоидов – это мобилизация энергетических ресурсов организма.
4. Глюкокортикоиды угнетают все компоненты воспалительной реакции – уменьшают проницаемость капилляров, тормозят экссудацию, снижают интенсивность фагоцитоза. Это свойство используется в клинической практике – для снятия воспалительных реакций, например, после проведения операции на глазу по поводу катаракты больному рекомендуется ежедневно вводить глазные капли, содержащие глюкокортикоиды (кортизон, гидрокортизон).
5. Глюкокортикоиды резко снижают продукцию лимфоцитов (Т- и В-) в лимфоидной ткани – при массивном повышении уровня в крови глюкокортикоидов наблюдается опустошение тимуса, лимфатических узлов, снижение в крови уровня лимфоцитов. Под влиянием глюкокортикоидов снижается продукция антител, уменьшается активность Т-киллеров, снижается интенсивность иммунологического надзора, снижается гиперчувствительность и сенсибилизация организма. Все это позволяет рассматривать глюкокортикоиды как активные иммунодепрессанты.
6. Глюкокортикоиды, вероятно, повышают чувствительность гладких мышц сосудов к катехоламинам, поэтому на фоне глюкокортикоидов повышается спазм сосудов, особенно мелкого калибра, и возрастает артериальное давление. Это свойство глюкокортикоидов, вероятно, лежит в основе таких явлений, как язвы желудка в двенадцатиперстной кишки, нарушение микроциркуляции в сосудах миокарда и как следствие – развитие аритмии, нарушение физиологического состояния кожных покровов – экземы, псориаз.
Все эти явления наблюдаются в условиях повышенного содержания эндогенных глюкокортикоидов (при стресс-реакции) или в условиях длительного введения глюкокортикоидов с лечебной целью.
7. В низких концентрациях глюкокортикоиды вызывают повышение диуреза – за счет увеличения скорости клубочковой фильтрации и, возможно, за счет угнетения выброса АДГ. Но при высоких концентрациях глюкокортикоиды ведут себя как альдостерон – вызывают задержку натрия и воды в организме.
8. Глюкокортикоиды повышают секрецию соляной кислоты и пепсина в желудке, что вместе с сосудосуживающим эффектом приводит к появлению язв желудка.
9. При избыточном количестве глюкокортикоиды вызывают деминерализацию костей, остеопороз, потерю кальция с мочой, снижают всасывание кальция в кишечнике, ведут себя как антагонист витамина Д3.
В этих же условиях вследствие торможения синтеза белка в скелетных мышцах наблюдается у человека мышечная слабость.
10. За счет активации липолиза при действии глюкокортикоидов повышается интенсивность перекисного окисления липидов (ПОЛ), что приводит к накоплению в клетках продуктов этого окисления, существенно нарушающих функцию плазматической мембраны.
11. Глюкокортикоиды влияют и на деятельность ЦНС, на функцию ВНД – они повышают обработку информации, улучшают восприятие внешних сигналов, действующих на многие рецепторы – вкусовые, обонятельные и т.п. Однако при недостатке и особенно при избыточном содержании глюкокортикоидов наблюдаются существенные изменения в состоянии ВНД – вплоть до возникновения шизофрении (при длительном стрессе!).
12. Участие в развитии общего адаптационного синдрома – стресс-реакции.
Регуляция секреции глюкокортикоидов
Глюкокортикоиды принадлежат к той группе гормонов, концентрация которых в плазме поддерживается на постоянном уровне за счет регуляторных механизмовв течение более или менее длительных периодов времени. Циркадианные колебания (более низкие концентрации наблюдаются в ночное время по сравнению с дневным) можно рассматривать как результат сдвига заданного значения в ходе 24-часового ритма. Самое высокое содержание глюкокортикоидов в крови в 6-8 часов утра. Необходимо помнить, что значительная часть кортизола в плазме связана с α-глобулином (транскортином), а другая фракция связана с альбуминами плазмы. Однако несущественно, какая из концентраций регулируется, потому что относительные концентрации свободных и связанных кортикоидов в плазме и клеточных кортикоидов определяются исключительно физическими законами (действия массы и диффузии).
Регуляция концентрации кортизола осуществляется следующим образом: рилизинг-гормон КРГ, образованный в гипофизотропной зоне гипоталамуса, достигает аденогипофиза по воротным сосудам и там вызывает выделение АКТГ (рис. 5.2.2); АКТГ доставляется кровью к коре надпочечника, где он стимулирует выделение глюкокортикоидов. Эта последовательность событий установлена двумя основными группами экспериментов.
· Демонстрацией того, что секреция АКТГ и глюкокортикоидов усиливается после электрической стимуляции срединного возвышения.
· Демонстрацией того, что усиление секреции АКТГ и кортизола, в норме индуцируемое стрессорными факторами, не определяется после электрокоагуляции ограниченных участков срединного возвышения.
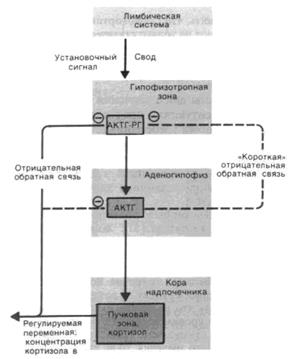
Рис. 5.2.2. Схема регуляции секреции глюкокортикоидов в коре надпочечника посредством КРФ и АКТГ; отрицательная обратная связь тормозит в первую очередь секрецию КРФ (влияя на АКТГ лишь незначительно).
Данные, полученные во 2-й серии экспериментов, показали также, что образование рилизинг-фактора в гипофизотропной зоне находится под контролем высших центров ЦНС, которые получают и перерабатывают сигналы, поступающие с периферии организма (некоторые – от органов чувств). Результаты этих опытов дают также основание к трактовке наблюдений о том, что эмоциональное состояние и поведение отражаются на секреторной активности коры надпочечников.
Отрицательная обратная связь. Микроинъекция глюкокортикоидов в гипофизотропную зону вызывает заметное снижение секреции АКТГ. Секреция АКТГ изменяется также при их же инъекции в аденогипофиз. Эти эффекты указывают на то, что рецепторы глюкокортикоидов, которые оказывают влияние на секрецию АКТГ через цепь отрицательной обратной связи, располагаются как в гипофизотропной зоне, так и в самом гипофизе (рис. 5.2.2.). В гипофизотропной зоне кортикоиды влияют на выделение КРГ, а в аденогипофизе они модулируют влияние КРГ на выделение АКТГ.
Недавно было показано, что АКТГ способен непосредственно ингибировать свою собственную выработку через так называемую короткую цепь обратной связи; местом его действия, как предполагается, являются нейросекреторные клетки гипофизотропной зоны.
Эффекты альдостерона
Альдостерон увеличивает активный транспорт Na+ через клеточные мембраны. В почке эффект заключается в повышении реабсорбции Na+ в канальцах и, вследствие осмотических явлений, реабсорбции воды. Кроме того, А стимулирует секрецию К+ и Н+. Альдостерон сходным образом влияет на потовые, слюнные и кишечные железы. Это внепочечные эффекты альдостерона. Содержание NaCl в секрете потовых желез, которое в норме значительно ниже, чем в плазме, при недостаточности альдостерона резко возрастает. Поэтому в случаях недостаточности альдостерона потоотделение, вызванное повышенной температурой окружающей среды, способно быстро привести к опасной потере NaCl. Одним из факторов адаптации к теплу является усиление секреции альдостерона, в результате чего содержание NaCl в поту снижается. Латентный период действия альдостерона на почки составляет около 30 мин; это время достаточно для индукции ферментов, которая, как предполагают, является основой действия альдостерона. При избытке альдостерона – гиперволемия: активация канальцевой реабсорбции Na+ и секреции К+; поддержание осмотического давления, возбудимости клеток, артериального давления; регуляция ионного транспорта в потовых и слюнных железах и желудочно – кишечном тракте; при избытке – гиперволемия, гипертензия, отеки, гипокалиемия, алкалоз, нарушения сердечного ритма, повышение экскреции магния и кальция; при недостатке – гиповолемия, гипотензия, гиперкалиемия, ацидоз, нарушения сердечного ритма, мозговые нарушения, избыток вазопрессина, нарушения пищеварения.
Регуляция секреции альдостерона
В очень большом количестве исследований показано, что к увеличению секреции альдостерона приводят три основных состояния: 1) усиленное потребление калия, 2) отрицательный баланс натрия (например, сниженное содержание соли в пище или значительные потери NaCl с потом) и 3) уменьшение объема плазмы (например, при кровопотере или неадекватном потреблении жидкости). Увеличение скорости секреции альдостерона под влиянием этих факторов осуществляется следующими механизмами.
- Ренин-ангиотензинонный механизм. Секреция альдостерона усиливается ангиотензином II, который приносится к коре надпочечника кровью и, следовательно, служит «тропным» гормоном для секреции альдостерона. Ангиотензин II представляет собой октапептид, образующийся под влиянием ренинаиз ангиотензина I, циркулирующего в плазме.
- АКТГтакже влияет на секрецию альдостерона, однако этот эффект выражен слабее, чем в отношении секреции глюкокортикоидов.
- Образующие гормон клетки клубочковой зоны непосредственно реагируют на изменения концентрации Na и К в плазме, изменяя секрецию альдостерона.
Ренин секретируется в юкстагломерулярном аппарате (ЮГА) почек. ЮГА образован специальными клетками, окружающими капиллярный клубочек.
Секреция ренина в ЮГК регулируется четырьмя основными влияниями. Во-первых, величиной давления крови в приносящей артериоле, т.е. степенью ее растяжения. Снижение растяжения активирует, а увеличение – подавляет секрецию ренина. Во-вторых, регуляция секреции ренина зависит от концентрации натрия в моче дистального канальца, которая воспринимается клетками – своеобразным Na-рецептором клеток ЮГА. Чем больше натрия оказывается в моче канальца, тем выше уровень секреции ренина. В-третьих, секреция ренина регулируется симпатическими нервами, ветви которых заканчиваются на ЮГК, медиатор норадреналин через β-адренорецепторы стимулирует секрецию ренина. В-четвертых, регуляция осуществляется по механизму отрицательной обратной связи, включаемой уровнем в крови других компонентов системы – ангиотензина и альдостерона, а также их эффектами – содержанием в крови натрия, калия, артериальным давлением, концентрацией простагландинов в почке, образующихся под влиянием ангиотензина (рис.5.2.3.).
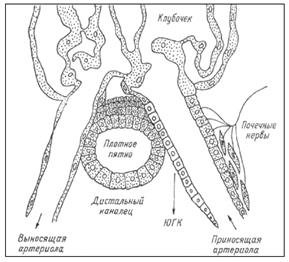
Рис. 5.2.3. Структура юкстагломерулярного аппарата. ЮКГ – юкстагломерулярные клетки.
Кроме почек образование ренина происходит в стенках кровеносных сосудов многих тканей, головном мозге, слюнных железах.
Ренин является ферментом, приводящим к расщеплению α-глобулина плазмы крови - ангиотензиногена, образующегося в печени. При этом в крови образуется малоактивный декапептид ангиотензин-I, который в сосудах почек, легких и других тканей подвергается действию ангиотензин-превращающего фермента (АПФ), отщепляющего от ангиотензина-I две аминокислоты. Образующийся октапептид ангиотензин-II обладает большим числом различных физиологических эффектов, в том числе стимуляцией клубочковой зоны коры надпочечников, секретирующей альдостерон, что и дало основание называть эту систему ренин-ангиотензин-алъдостероновой (рис. 5.2.4.).
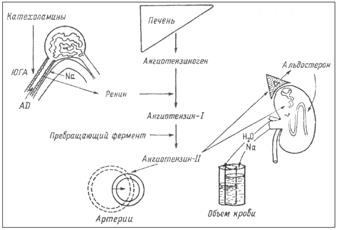
Рис. 5.2.4. Ренин-ангиотензивная-альдостероновая система.
Ангиотензин-II кроме стимуляции продукции альдостерона, вызывает мощный спазм артериальных сосудов, увеличивает реабсорбцию натрия и ослабляет клубочковую фильтрацию в почках, способствует формированию чувства жажды и питьевого поведения.
Таким образом, ренин-ангиотензин-альдостероновая система участвует в регуляции почечного кровообращения, объема циркулирующей крови, осмотического давления, водно-солевого обмена и поведения (рис. 5.2.5.).
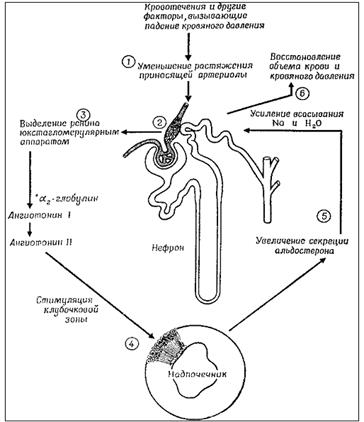
Рис. 5.2.5. Регуляторная роль почек в секреции альдостерона.
Ангиотензин-II кроме стимуляции продукции альдостерона, вызывает мощный спазм артериальных сосудов, увеличивает реабсорбцию натрия и ослабляет клубочковую фильтрацию в почках, способствует формированию чувства жажды и питьевого поведения.
Таким образом, ренин-ангиотензин-альдостероновая система участвует в регуляции почечного кровообращения, объема циркулирующей крови, осмотического давления, водно-солевого обмена и поведения (рис. 5.2.5.).
Эти три регуляторных механизма достаточно эффективно компенсируют воздействия, приводящие к нарушению водно-солевого равновесия. Благодаря этим взаимосвязанным функциям альдостерониграет существенную роль в цепях регуляции, поддерживающих постоянство концентрацииNa/K в плазме иособенно объема жидкости в организме. С кибернетической точки зрения альдостерон является контролирующим элементом в нескольких переплетающихся биологических регуляторных цепях.
Эффекты надпочечниковых андрогенов
Основные надпочечниковые андрогены дегидроэпиандростерон (ДГЭАС), дегидроэпиандростерон-сульфат (ДГЭАС-сульфат) и андростендион обладают анаболическим эффектом. Они стимулируют синтез белка, увеличивают мышечную массу и сократительную способность мышц. Действие надпочечниковых андрогенов как половых гормонов очень слабое. Андростендион может превращаться в периферических тканях в тестостерон и в условиях его избытка у женщин может развиться гирсутизм и вирилизм.
Синтезированы и нашли широкое применение в клинике аналоги андрогенов, активирующие синтез белка и обладающие минимальным вирилизирующим действием (анаболические стероиды).
Физиологическая роль андрогенов в женском организме заключается в основном в воздействии на белковый обмен.
Значение эстрогенов у мужчин не ясно.
Физиологическое значение надпочечниковых андрогенов у мужчин аналогично роли полового гормона тестостерона. Но после кастрации увеличивается толщина сетчатой зоны, но компенсировать недостаток андрогенов и играть роль «третьей гонады» надпочечники не в состоянии.
Заболевания надпочечников
Аддисонова болезнь. В 1855 г. Addison опубликовал первое исчерпывающее сообщение о клинике и причине этого заболевания. Это сравнительно редкое заболевание возникает в результате поражения обоих надпочечников. Симптомы: сильная пигментация кожи, преобладающий дымчато-серый, бронзовый оттенок особенно на лице, тыльных поверхностях кистей и участках тела, подвергающихся трению одеждой; слизистая рта, десен, языка также пигментирована; наблюдается прогрессирующая мышечная слабость, быстрая утомляемость; гипотония; память слабеет; рвота, поносы; резкое ухудшение; гипонитриемия, гиперкалиемия.
Адрено-генитальный синдром – избыточная продукция андрогенов надпочечников, вследствие гиперплазии или опухоли коры надпочечников. У женщин встречается в 5 раз чаще, чем у мужчин. Если гиперпродукция андрогенов коры надпочечников начинается у девочек еще во время внутриутробного развития, то возникает аномалии строения внутренних и наружных половых органов – ложный гермафродизм. Половые органы недоразвиты. Если заболевают мальчики – преждевременное развитие вторичных половых признаков.
У детей обоего пола при адрено-генитальном синдроме наступает усиленный рост скелета и сильное развитие мускулатуры, что сопровождается значительным увеличением мышечной силы.
У взрослых женщин развивается вирилизм и гирсутизм.
Вирилизм – появление у женщин ряда типичных мужских черт и ослабление женских вторичных половых признаков. Развивается мужской облик лица, типичное для мужского строения туловище, огрубение голоса, уменьшение размера молочных желез, изменение наружных половых органов. На лице растут борода и усы, волосистость на теле распределяется по мужскому типу.
Гирсутизм – усиленное развитие у женщин волосяного покрова на лице, туловище и конечностях, не сопровождающееся изменениями в половом аппарате, строении тела, вторичных половых признаков.
Синдром Конна (первичный альдостеронизм) – причина – опухоль или гиперплазия клубочковой зоны коры надпочечников. Основные симптомы: периодически повторяющиеся приступы мышечной слабости, изменение кожной чувствительности, судорожные приступы и параличи. Гипокалиемия, что ведет к изменению миокарда.
Синдром Кушинга – полиэтиологичное заболевание, подавляющее большинство клинических проявлений которого является следствием хронического избытка кортизола в организме и избыточного его действия на органы и ткани. Осложнения: компрессионные переломы позвоночника; переломы шейки бедра. Образование камней в почках - нефролитиаз, на фоне которого часто развивается пиелонефрит. Кальций может откладываться в паренхиме почек с развитием нефрокальциноза и, в конечном итоге, хронической почечной недостаточности. Артериальная гипертензия может осложниться мозговыми инсультами и в сочетании с гиперлипидемией и гиперинсулинемией способствует раннему развитию и тяжелому течению атеросклероза, в частности коронарных артерий. Кроме того, катаболические процессы, затрагивающие и сердечную мышцу, приводят к развитию кардиодистрофии, которая может проявляться сердечной недостаточностью и нарушениями ритма сердца. Больные могут умереть от инфаркта миокарда, мозгового инсульта и сердечной недостаточности.
Препараты гормонов коры надпочечников
Первый активный препарат коры надпочечников был получен в 1927 г. Это кортин. В 30-40-е годы были открыты и выделены кортизол, кортизон, ДОК.
Далее синтезированы преднизолон (аналог кортизола (гидрокортизола), преднизон (аналог кортизона)).
Получены кортикостероиды (КС) с избирательным действием подобные глюкокортикоидам (ГК) без минералокортикоидного (МК) эффекта – триамсинолон, дексаметазон.
Толчком к интенсивным исследованиям и синтезу синтетических аналогов КС послужили результаты Hench c соавт. (1948) о высокой эффективности кортизона при лечении больных ревмотоидным полиартритом. Филип Хенч обратил внимание на то, что у больных ревматическими заболеваниями при беременности или желтухе наступает выраженное облегчение состояния. Он предположил, что улучшение самочувствия может быть обусловлено появлением в организме больных какого-то стероидного вещества, подобного либо половым гормонам, выделяемым при беременности в повышенных количествах, или желчным кислотам, накапливающиеся при желтухе. 21 сентября 1948 года была сделана первая попытка лечения кортизоном больного, страдавшего тяжелым хроническим суставным ревматизмом. Через несколько дней больной, который в течение 6 лет не мог подняться с постели из-за мучительных болей, самостоятельно встал. Таким образом, в 1948 году получила права гражданства кортикостероидная терапия, которая открыла новую эру в лечении ревматизма и спасла миллионы человеческих жизней. Научный мир по достоинству оценил это открытие. Кевдэлл, Хенч и Рейхштейн в 1950 году были удостоены Нобелевской премии. В дальнейшем началось широкое и во многих случаях очень эффективное применение КС при различных заболеваниях неэндокринной природы.
Таким образом, терапию КС и их синтетическими аналогами используют в двух планах: 1) заместительная при гипокортицизме; 2) фармакологическую – используют их противовоспалительное и иммуносупрессивное действие. Угнетение иммунологических свойств связано с инволюцией тимико-лимфотической системы, а также с катаболическим действием (угнетается синтез антител).
Возможные осложнения терапии кортикостероидами:
1) отложение жира в верхней половине туловища и лица (паукообразное ожирение);
2) стероидный диабет;
3) остеопороз и патологические переломы;
4) задержка роста детей;
5) стрии;
6) гирсудизм;
7) нарушение заживления ран;
8) мышечная слабость и миопатии;
9) отеки;
10) язвы ЖКТ;
11) гипертония;
12) изменение функционального состояния ЦНС;
13) нарушение mensis;
14) генерализация инфекций. Атрофия НП и синдром отмены.
Заболевания надпочечников (хронические недостатки коры надпочечников)
Аддисонова болезнь. В 1855 Addison опубликовал первое исчерпывающее сообщение о клинике и причине этого заболевания. Это сравнительно редкое заболевание, возникает в результате поражения обоих надпочечников, реже другое заболевание.
Симптомы. Сильная пигментация кожи, приобретающей дымчато-серый, бронзовый оттенок.
Глюкокортикоиды применяются с лечебной целью как мощное противовоспалительное, десенсибилизирующее средство. Впервые с этой целью их применил Хенч.
Филип Хенч обратил внимание на то, что у больных ревматическими заболеваниями при беременности или желтухе наступает выраженное облегчение состояния. Ученый совершенно правильно предположил, что улучшение самочувствия может быть обусловлено появлением в организме больных какого-то стероидного вещества, подобного либо половым гормонам, выделяемым при беременности в повышенных количествах, или желчным кислотам, накапливающиеся при желтухе. 21 сентября 1948 года была сделана первая попытка лечения кортизоном больного, страдавшего тяжелым хроническим суставным ревматизмом. Ученые не скрывали своих планов, и вся клиника с волнением следила за результатами эксперимента. Через несколько дней случилось чудо. Больной, который в течение 6 лет не мог подняться с постели из-за мучительных болей, самостоятельно встал. Попробовали новый метод лечения на другом больном – результат опять превзошел все ожидания. И пусть потом при детальных исследованиях ажиотаж первоначального восторга спал, обнаружились побочные эффекты действия гормонов коры надпочечников, и пришлось ограничить их применение, это уже неважно, с этим врачи научились справляться. Главное, что в 1948 году получила права гражданства кортикостероидная терапия, которая открыла новую эру в лечении ревматизма и спасла миллионы человеческих жизней. Научный мир по достоинству оценил это открытие. Кевдэлл, Хенч и Рейхштейн в 1950 году были удостоены Нобелевской премии.
Дата добавления: 2015-12-16; просмотров: 1211;
