Последовательность реакций и число синтезированных молекул в аденилатциклазной системе
| Число молекул | Вид молекул |
| гормон+рецептор | |
| аденилатциклаза | |
| цАМФ | |
| 1 000 | активная протеинкиназа |
| 10 000 | фосфорилированные энзимы |
| 1 000 000 | конечные продукты реакции |
Такое биохимическое усиление в каскаде помогает понять, каким образом гормоны и другие биологически активные вещества оказывают физиологические эффекты в чрезвычайно низких концентрациях.
Через аденилатциклазную систему действуют ФСГ, ЛГ, хорионический гонадотропин, МСГ, антидиуретический гормон (вазопрессин), катехоламины (когда их влияние осуществляется через β-адренергические рецепторы), глюкагон, паратирин, кальцитонин, секретин, гонадотропин, тиреолиберин, липотропин. Ответ на действие этих гормонов наблюдается уже через короткий промежуток времени и, как правило, прямо пропорционален количеству «вторичного мессенджера»- цАМФ.
Таким образом, цАМФ может вызвать разнообразные физиологические ответы благодаря тому, что он может фосфорилировать многие протеинкиназы, участвующие в инициации различных процессов.
Кроме этого, разнообразие этих эффектов может быть связано с тем, что протеинкиназы могут активировать одни энзимы, а другие – инактивировать.
Этот процесс происходит в клетках, мембрана которых содержит другой регуляторный белок Gi. Это ведет к уменьшению синтеза цАМФ, уменьшению фосфорилирования белков внутри клетки и соответствующему физиологическому ответу. Например, ингибирует аденилатциклазу соматостатин, ангиотензин II, адреналин через β-адренорецепторы активирует аденилатциклазу, а через α-адренорецепторы – подавляет.
2.Другой циклический нуклеотид – гуанозинмонофосфат (цГМФ) тоже может выступать в качестве вторичного мессенджера. Он образуется при активации (или ингибировании) гуанилатциклазы, локализованной в мембране, как и аденилатциклаза. цГМФ также стимулирует протеинкиназу, увеличивает число фосфорилированных белков, приводя к физиологическому ответу. Эта система распространена меньше, чем аденилатциклазная. В большинстве тканей биохимические эффекты цАМФ и цГМФ противоположны. Примерами могут служить стимуляция сокращений сердца под влиянием цАМФ и торможение их цГМФ, стимуляция сокращения гладких мышц кишечника цГМФ и подавление цАМФ. Ферментативный гидролиз цГМФ осуществляется с помощью специфической фосфодиэстеразы.
3.Ионы Са++ являются вторичными мессенджера разнообразных внутриклеточных процессов. В неактивированной клетке они присутствуют в низкой концентрации (10-8–10-7 М). В активированной клетке его концентрация возрастает до 10-5 М.
Увеличение концентрации ионов Са++ в цитоплазме клетки достигается двумя путями (рис. 3.3).
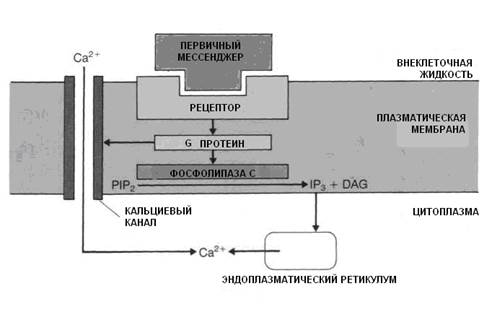
Рис. 3.3. Механизмы повышения концентрации Са++ в цитоплазме.
При связывании рецептора мембраны с гормоном (первичный мессенджер) открываются медленные неэлектрогенные кальциевые каналы мембран, в результате чего ионы Са++ из внеклеточной жидкости поступают в цитоплазму клетки.
Второй причиной возрастания концентрации ионов Са++ в цитоплазме является их выход из ЭПС и других органоидов клетки. Этот процесс имеет следующую последовательность: взаимодействие гормона с рецептором → активация протеина G в мембране, который стимулирует мембранную фосфолипазу С (рис. 3.4).
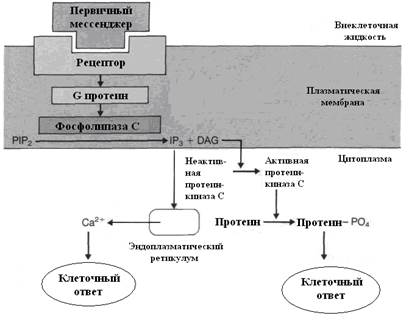
Рис. 3.4. Образование вторичных мессенджеров – инозитол-3-фосфата и диацилглицерола и их роль в механизмах действия гормонов.
4.Этот энзим вызывает гидролиз фосфолипидов (PIP2) мембраны с образованием двух вторичных посредников: инозитол-3-фосфата (IP3) и диацилглицерола (DAG). Инозитол-3-фосфат стимулирует выход Са++ из внутриклеточных депо, в основном из эндоплазматического ретикулума.
При возрастании концентрации Са++ в цитозоле до 10-5 М последний связывается с белком цитозоля кальмодулином.
Кальмодулин - рецепторный белок с высокой аффинностью к кальцию, состоит из 148 аминокислотных остатков и присутствует во всех содержащих ядро клетках. Его молекулярная масса 17 000, каждая молекула имеет 4 рецептора для связывания кальция.
В мышечных клетках роль кальмодулина выполняет тропонин С. Связанный с кальцием кальмодулин изменяет свою пространственную организацию и активирует многочисленные протеинкиназы, обеспечивающие фосфорилирование белков.
Кальмодулин активирует фосфодиэстеразу цАМФ, что подавляет ее эффект как вторичного посредника. Кратковременное увеличение в клетке кальция и его связывание с кальмодулином является пусковым стимулом для многочисленных физиологических процессов — сокращения мышц, секреции гормонов и выделения медиаторов, синтеза ДНК, изменения подвижности клеток, транспорта веществ через мембраны, изменения активности ферментов (рис. 3.5.).
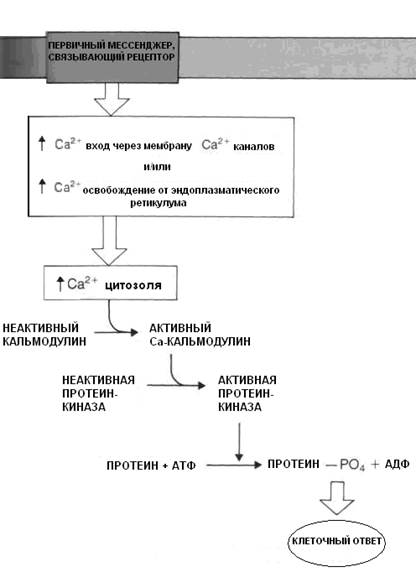
Рис. 3.5. Механизм возрастания концентрации Са++ в цитозоле и его роль как вторичного мессенджера.
5. Другой вторичный посредник, образующийся при гидролизе фосфолипидов мембран, диацилглицерол (DAG), без участия кальмодулина, активирует протеинкиназу С, что также завершается процессами фосфорилирования других белков и развитием физиологического ответа (секреция, сокращение и т.д.).
Кальциевый механизм действия свойственен ангиотензинам, окситоцину, кальцитонину, паратгормону и т.д.
Таким образом, в основе действия таких вторичных мессенджеров как цАМФ, цГМФ, DAG, активированный Са++ кальмодулин лежит их способность активировать протеинкиназу.
В большинстве клеток организма присутствуют или могут образовываться почти все из рассмотренных выше вторичных посредников, за исключением лишь цГМФ. В связи с этим, между вторичными посредниками устанавливаются различные взаимосвязи: 1) равноправное участие, когда разные посредники необходимы для полноценного гормонального эффекта; 2) один из посредников является основным, а другой лишь способствует реализации эффектов первого; 3) посредники действуют последовательно (например, инозитол-3-фосфат обеспечивает освобождение кальция, диацилглицерол облегчает взаимодействие кальция с протеинкиназой С); 4) посредники дублируют друг друга для обеспечения избыточности с целью надежности регуляции; 5) посредники являются антагонистами, т.е. один из них включает реакцию, а другой — тормозит (например, в гладких мышцах сосудов инозитол-3-фосфат и. кальцин реализуют их сокращение, а цАМФ — расслабление).
Иной механизм действия стероидных гормонов (рис. 3.6), к которым относятся гормоны коры надпочечников и половые гормоны. Стероидные гормоны транспортируются в крови в связанном с белками состоянии, и лишь незначительная их часть находится в свободной форме. Гормон, находящийся в свободной форме, способен взаимодействовать с мембраной клетки и проходить через нее в цитоплазму, где связывается с цитоплазматическим рецептором, который отличается высокой специфичностью. Например, из гепатоцитов выделены рецепторные белки, связывающие только глюкокортикоиды или эстрогены. В настоящее время идентифицированы рецепторы к эстрадиолу, андрогенам, прогестерону, глюкокортикоидам и минералокортикоидам. Концентрация рецепторов в соответствующих тканях-мишенях составляет от 103 до 5х104 на клетку. Стероидные рецепторы являются белками с мол. м. около 70 000.
Считается, что стероидные гормоны образуют с цитоплазматическим рецептором гормонорецепторный комплекс, который подвергается трансформации и перемещается (транслоцируется) в ядро, где стероид связывается ядерным хроматином. Возможно поступление гормона в ядро без предварительного связывания его с цитоплазматическим рецептором.
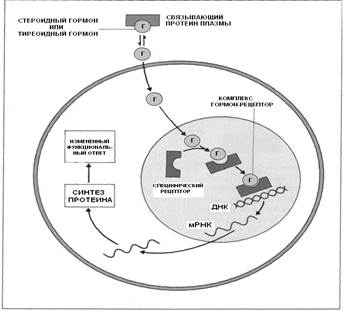
Рис. 3.6. Механизмы действия стероидных и тиреоидных гормонов.
Наряду с этим имеются данные, что стероиды вначале могут связываться со специфическими белками мембраны клетки, которые транспортируют их или к цитоплазматическому рецептору, или, минуя его, непосредственно к рецепторам ядра. В ядре клетки гормон-рецепторный комплекс, взаимодействуя с ДНК, триггирует (запускает) процесс транскрипции, в результате образуется мРНК, с последующим синтезом специфического белка, что и приводит к развитию физиологического ответа. Эффект действия стероидных гормонов проявляется не сразу, а спустя определенное время, которое необходимо для образования РНК и последующего синтеза специфического белка.
Тиреоидные гормоны (тироксин T4 и трийодтиронин - Т3), так же как и стероидные, легко диффундируют через липидную клеточную мембрану и взаимодействуют с внутриклеточными рецепторами. По другим данным, сначала они взаимодействуют с рецептором на плазматической мембране и лишь после этого попадают в цитоплазму, где комплексируются с белками, образуя так называемый внутриклеточный пул тиреоидных гормонов. Сродство внутриклеточных рецепторов к трийодтиронину (Т3) в 10-20 раз больше, чем к Т4 (тироксину). Поэтому биологическое действие в основном осуществляется Тз, а Т4 превращается в Тз, который связывается с ядерными, цитоплазматическим и митохондриальными рецепторами.
Тиреоидные гормоны регулируют синтез белка на уровне транскрипции, и это их действие, обнаруживаемое через 12-24 ч, может быть блокировано введением ингибиторов синтеза РНК. Помимо внутриклеточного действия, тиреоидные гормоны стимулируют транспорт глюкозы и аминокислот через клеточную мембрану, непосредственно влияя на активность некоторых локализованных в ней ферментов.
Таким образом, специфическое действие гормона проявляется лишь после комплексирования его с соответствующим рецептором. Это вызывает последовательную цепь пострецепторных взаимодействий, заканчивающихся проявлением специфического биологического эффекта гормона.
Отсюда следует, что биологическое действие гормона зависит не только от его содержания в крови, но и от количества и функционального состояния рецепторов, а также от уровня функционирования пострецепторного механизма.
Количество клеточных рецепторов, как и других компонентов клетки, постоянно изменяется, отражая процессы синтеза и разрушения.
Например, для каждого вида гормонов имеются агонисты и антагонисты. Последние представляют собой вещества, которые способны конкурентно связывать рецептор к гормону, снижая его биологический эффект. Агонисты, наоборот, комплексируясь с соответствующим рецептором, усиливают действие гормона. Так, для кортизола прогестерон является антагонистом, кортикостерон - агонистом, а альдостерон - слабым агонистом. Антагонистом альдостерона служит спиронолактон. Эти взаимоотношения учитывают не только в эксперименте при уточнении механизма действия гормонов, но и в клинической практике, которые не оказывают биологического эффекта. Например, прогестерон, являясь антиглюкокортикоидом, связывает рецепторы глюкокортикоидов, эстрогены – антиандрогены – связывают рецепторы андрогенов, но не оказывает их специфического действия.
Второй способ регуляции чувствительности клетки к гормону – переход рецептора вместе со связанным с ним гормоном в цитоплазму или в ядро. Это явление получило название интернализации. В результате уменьшения концентрации мембранных или цитоплазматических рецепторов, снижается скорость их взаимодействия с вновь входящим в клетку гормоном.
Важную роль в регуляции числа рецепторов играет скорость их синтеза и разрушения, регулируемая гормонами. Например, эстрогены резко повышают уровень прогестиновых рецепторов в клетках матки и яйцеводов и рецепторов окситоцина в молочной железе и матке. Эти данные хорошо согласуются с известными данными о том, что эстрогены сенсибилизируют (повышают чувствительность) к прогестину и окситоцину этих тканей.
При старении не только снижается секреция половых гормонов, но и значительно снижается число рецепторов к половым гормонам в тканях-мишенях.
Одна из наиболее изученных форм патологии рецепторного аппарата – ожирение, сопряженное с инсулинорезистентностью. При этом наблюдается недостаточность мембранных рецепторов инсулина, приводящей к ареактивности клеток-мишеней к гормонам.
Инсулинонезависимый диабет характеризуется нормальной секрецией инсулина, но при этом наблюдается снижение, как числа инсулиновых рецепторов, так и их чувствительности к инсулину. Поэтому имеет место снижение связывания инсулина. Это явление было обнаружено у многих клеток – жировых, эритроцитах, нейтрофилах, Т-лимфоцитах и т.д.
Синдром тестикулярной феминизации – генетически обусловленное заболевание, проявляющееся в форме врожденного мужского псевдогермафротизма. При этом заболевании секреция тестостерона не изменена, но резко снижено, иногда до нуля число андрогенных рецепторов.
Аналогично у женщин при нормальной секреции эстрогенов может быть снижено число рецепторов к ним. Результат – мужеподобный вид и т.д. (синдром Марриса; например, у Жанны д’Арк).
Важное значение имеет тот факт, что клетки некоторых опухолей могут содержать малое или большое число рецепторов. Например, при раке молочной железы увеличение числа рецепторов к эстрогенам в опухолевых клетках ведет к увеличению влияния на рост опухоли этих гормонов. Поэтому в настоящее время определяется содержание рецепторов к различным гормонам в опухолевых клетках, что позволяет эффективно проводить гормонотерапию. Например, при наличии рецепторов к эстрогенам применяются антиэстрогены (арамитекс) в менопаузе, в молодом возрасте – кастрация.
При применении эстрогенов в качестве средства борьбы с менопаузой – резко увеличилось число больных с раком молочной железы.
ГИПОФИЗ
Гипофиз располагается в основании черепа, в выемке решетчатой кости, которая называется «турецкое седло». Гипофиз окружен твердой мозговой оболочкой и сверху его отделяет от других частей мозга диафрагма турецкого седла (рис. 4.1). Она препятствует попаданию в турецкое седло спинномозговой жидкости. К гипофизу через отверстие в диафрагме проходит ножка гипофиза, окруженная кровеносными сосудами. Вес гипофиза колеблется от 600 до 1200мг. Во время беременности вес гипофиза увеличивается за счет гипертрофии лактотрофов и увеличения кровотока.
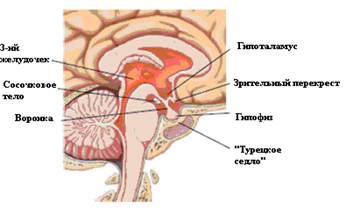
Рис. 4.1. Взаимосвязь гипофиза с гипоталамусом.
Гипофиз состоит из двух долей – большей передней доли и меньшей задней доли. Передняя доля, или аденогипофиз, эктодермального происхождения. Она образуется из эктодермы орофарингса, которая внедряется в турецкое седло. Задняя доля, или нейрогипофиз, образуется путем инвагинации в турецкое седло вентрального отдела гипоталамуса. Задняя доля состоит из аксонов нейронов, расположенных в супраоптических и паравентрикулярных ядрах гипоталамуса. Аксоны этих клеток проходят через ножку гипофиза. В задней доле оканчиваются на капиллярах, которые собираются в вену задней доли, впадающую в кавернозный синус. В задней доле освобождаются в кровоток гормоны, синтезированные в гипоталамусе, – вазопрессин и окситоцин.
Между задней и передней долями гипофиза располагается очень небольшая часть гипофиза, остаток кармана Ратке, которая называется средней долей. У человека она практически гормонально неактивна. Предполагается, что в ней может синтезироваться предшественник АКТГ – меланоцитостимулирующий гормон.
Дата добавления: 2015-12-16; просмотров: 1216;
