МЕТОДОМ КЛЕМАНА И ДЕЗОРМА
Молярной теплоемкостью с какого-либо вещества называют физическую величину, численно равную количеству теплоты, которое нужно сообщить одному молю вещества, чтобы повысить его температуру на один градус:
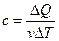 , (1)
, (1)
где v – число молей данного вещества.
Для газов теплоемкость существенно зависит от того, при каких условиях сообщают системе теплоту. Так, в случае нагревания газа при постоянном объеме сообщенная ему теплота идет на изменение внутренней энергии газа, и теплоемкость cv при постоянном объеме определяется соотношением
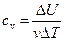 . (2)
. (2)
Если же газ нагревать при постоянном давлении, то при этом не только изменяется внутренняя энергия, но и совершается работа по расширению газа, и теплоемкость cp при постоянном давлении может быть определена из соотношения
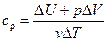 . (3)
. (3)
Поэтому для газа, подчиняющегося уравнению Менделеева-Клапейрона, получается следующее равенство
сp = сv + R, (4)
где R – универсальная газовая постоянная. Равенство (4) часто называют уравнением Роберта Майера.
Для идеального газа теплоемкости cp и cv можно рассчитать, исходя из представлений классической молекулярно-кинетической теории. Используя теорему о равномерном распределении кинетической энергии по степеням свободы молекулы, можно записать, что внутренняя энергия одного моля газа будет равна
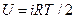 , (5)
, (5)
где i – число поступательных и вращательных степеней свободы молекулы. Отсюда имеем:
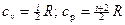 . (6)
. (6)
Отношение молярных (или удельных) теплоемкостей при постоянном давлении и при постоянном объеме
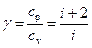 (7)
(7)
играет в термодинамике важную роль. В частности, эта величина входит в уравнение Пуассона
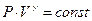 , (8)
, (8)
описывающее адиабатный процесс для идеальных газов. В связи с этим величина отношения теплоемкостей сp/сv для газов играет очень большую роль при адиабатных процессах и при процессах, близких к ним. Для примера укажем, что ею, в частности, определяется скорость распространения звука в газах, от нее зависит течение газов по трубам со звуковыми скоростями и достижение сверхзвуковых скоростей в расширяющихся трубах.
§2. Описание метода Клемана и Дезорма определения сp/сv
Клеман и Дезорм в 1819 году предложили и осуществили следующий метод измерения отношения теплоемкостей g = cp/cv для газов. Данный метод чрезвычайно прост.
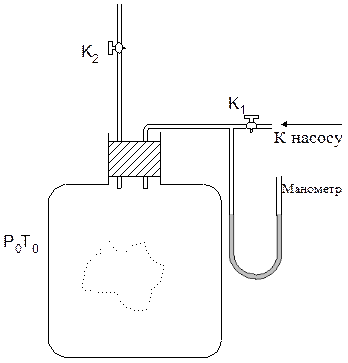
Рис. 1. Схема экспериментальной установки.
Пусть мы имеем стеклянный сосуд, соединенный с манометром. Посредством крана К2 сосуд может соединяться с атмосферой, и пусть первоначально в нем было атмосферное давление Р0. Температура окружающей среды Т0.
1). Кран К2 закрыт. Через кран К1 с помощью насоса в баллон накачивается воздух, затем кран К1 закрывается. Спустя некоторое время температура газа в баллоне сравняется с температурой окружающей среды. После этого водяным манометром измеряют давление газа в баллоне. Назовем это состояние газа состоянием 1.
2). Затем на короткое время открывают кран К2. При открытом кране К2 часть газа выйдет из баллона и его давление сравняется с атмосферным. При этом газ, оставшийся в баллоне, адиабатно расширится, совершив работу против давления окружающего воздуха. Вследствие этого его температура понизится до некоторого значения Т. Назовем это состояние газа состоянием 2.
3). Затем кран К2 быстро закрывается, и газ начинает медленно нагреваться, пока его температура не сравняется с температурой Т0 окружающего воздуха. Пусть давление газа в этот момент равно Р2. Назовем это состояние состоянием 3.
Дата добавления: 2015-12-16; просмотров: 6009;
