Фотохимические реакции. Основные законы фотохимии
Под фотохимическими обычно понимают реакции, прохождение которых обусловлено действием света – излучением с частотами видимого спектра или близкими к ним.
Еще в начале XIX века было установлено, что химически активны лишь те лучи, которые поглощаются реагирующими веществами (закон Гротгуса – Дрепера, который иногда называют I законом фотохимии). Это утверждение очевидно и выполняется всегда. Однако обратное утверждение о том, что лучи, которые поглощается, являются химически активными, в общем случае является неверным, так как поглощение света не обязательно приводит к химической реакции.
Поглощение монохроматического света с длиной волны l описывается законом Ламберта – Бера: ослабление интенсивности dI света, прошедшего через слой толщиной dx, прямо пропорционально толщине слоя, интенсивности падающего света I и числу поглощающих частиц n (или их концентрации в слое):
– dI = kIdx (23.1)
где коэффициент пропорциональности k – молекулярный коэффициент поглощения, который является мерой поглощательной способности молекулы для данной длины волны и в первом приближении не зависит от концентрации. После интегрирования в пределах x от 0 до l (l -общая толщина поглощающего слоя) и I от Io (интенсивность падающего света) до I (интенсивность выходящего света) получим выражение закона Ламберта – Бера:
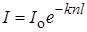 . (23.2)
. (23.2)
Если концентрацию выражать числом молей вещества в литре раствора (c), то
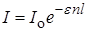 , (23.3)
, (23.3)
где e – молярный коэффициент поглощения, связанный с k соотношением kn = e c.
Бунзен и Роско (1855) установили, что химическое действие света прямо пропорционально произведению интенсивности света на время его действия. Эта зависимость является приближенной, так как отмечалось выше, не вся поглощенная световая энергия всегда полностью расходуется на химический процесс.
Обобщение всех закономерностей было сделано Вант-Гоффом (1904), который сформулировал количественную закономерность, лежащую в основе кинетики фотохимических реакций: количество фотохимически измененного вещества пропорционально поглощенной энергии света. Математическое выражение этой формулировки можно получить следующим образом. Количество световой энергии A, поглощенной в единицу времени фотохимической системой, равно по закону Ламберта – Бера
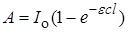 , (23.4)
, (23.4)
а количество фотохимически измененного вещества dc в единицу времени, т.е. скорость реакции, пропорциональна A:

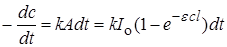 . (23.5)
. (23.5)
Если концентрация очень мала или поглощающий слой очень тонкий (l = dx, величина cl мала), то после разложения экспоненты в ряд получим
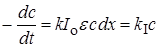 , (23.6)
, (23.6)
т.е. фотохимическая реакция протекает по первому порядку, ее скорость пропорциональна концентрации реагирующего вещества.
При больших концентрациях или толстом поглощающем слое (cl велико,
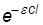 << 1) весь световой поток поглощается и
<< 1) весь световой поток поглощается и
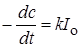 , (23.7)
, (23.7)
т.е. скорость реакции постоянна и не зависит от концентрации реагирующего вещества (нулевой порядок).
Наиболее важным для объяснения кинетики фотохимических реакций является закон квантовой эквивалентностиШтарка – Эйнштейна (1912), который гласит, что каждому поглощенному кванту излучения hn соответствует одна измененная молекула (второй закон фотохимии). Под изменением при этом понимается как химическое превращение, так и изменение энергетического состояния молекулы.
Число квантов света, поглощенных в единицу времени nhn =A/hn, следовательно, за это время изменению должны подвергнуться np = A/hn молекул. Но, как показывает опыт, очень часто число фотохимически прореагировавших молекул не равно числу поглощенных квантов. В связи с этим для характеристики фотохимических процессов введено понятие квантового выходаg. Квантовым выходом называется отношение числа химически прореагировавших молекул к числу поглощенных квантов:
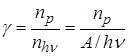 . (23.8)
. (23.8)
Тогда скорость химической реакции
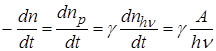 , (23.9)
, (23.9)
или с учетом уравнения (23.4)
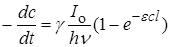 . (23.10)
. (23.10)
Это уравнение объединяет все законы фотохимии и представляет собой общее выражение для скорости фотохимической реакции.
23.2. Основные типы фотохимических процессов
В зависимости от величины квантового выхода все фотохимические реакции можно подразделить на четыре группы: 1) с квантовым выходом g = 1; 2) с квантовым выходом g < 1; 3) с квантовым выходом g > 1; 4) с квантовым выходом g >> 1. Примеры некоторых реакций различных групп приведены в таблице 23.1. В уравнениях реакций первым указано вещество, поглощающее свет.
Отклонения квантового выхода от единицы связано с механизмом протекания фотохимической реакции, в которой можно выделить три основные стадии:
1) начальный акт поглощения света;
2) первичный фотохимический процесс;
3) вторичные реакции.
Начальное действие света состоит в образовании электронно-возбужденной молекулы А*:
А + hn ® А*
Квантовый выход этого процесса в большинстве случаев равен единице. За начальным актом поглощения немедленно следуют первичные процессы превращения элекронно-возбужденной молекулы различного вида:
1. Флуоресценция А* ® А + hn
2. Дезактивация при соударении А* + М ® А + М
3. Спонтанная диссоциация А* ® В1 + В2
4. Диссоциация при столкновении А* + М ® В1 + В2 + М
5. Внутренняя перестройка А* ® В
6. Реакции с другими молекулами А* + В ® С
В результате процессов 1 – 2 возбужденная молекула дезактивируется и дальнейших превращений не происходит. В реакциях 5 – 6 образуются продукты и квантовый выход будет равен единице или меньше, если частично протекают также реакции 1 – 2.
В результате диссоциации в реакциях 3 – 4 могут образоваться как устойчивые, так и реакционно-способные молекулы, а также свободные радикалы и атомы. Именно свободные радикалы и атомы чаще всего образуются в результате диссоциации и, обладая высокой реакционной способностью, вступают во вторичные реакции различного типа.
Таблица 23.1
Характеристики некоторых фотохимических реакций
| Реакция | Длина волны, нм | Квантовый выход |
| O2 + H2 ® H2O2 (газ) | ||
| Br2 + C6H12 ® C6H11Br + HBr (газ) | ||
| Cl2 + 2CCl3Br ® 2CCl4 + Br2 (раствор в CCl4) | ||
| 2NH3 ® N2 + 3H2 (газ) | 200 – 220 | 0,15 – 0,2 |
| CH3Br ® (CH4, Br2) (газ) | 4.10-3 | |
| С6Н6 + 3Br2 ® С6H6Br6 (р-р в С6H6) | 300 – 550 | 0,4 – 0,9 |
| 2HBr ® H2 + Br2 (газ) | 207 – 254 | |
| Cl2 + SO2 ® SO2Cl2 (газ) | 2 – 3 | |
| 2HClO ® 2HCl + O2 (р-р в воде) | 366 – 436 | |
| Cl2 + CO ® COCl2 (газ) | 400 – 436 | 103 |
| Cl2 + H2 ® 2HCl (газ) | 303 – 500 | 104 – 106 |
| 2H2O2 ® 2H2O + O2 (р-р в воде) | 275 – 366 | 20 – 500 |
Таблица 23.2
Вторичные реакции с участием активных частиц
| Тип процесса | Уравнение реакции | Квантовый выход |
| 1. Рекомбинация | В1 + В2 ® А + М | <1 |
| 2. Реакция с продуктом или другими молекулами с регенерацией А | В1 + В ® А + С | <1 |
| 3. Нецепные реакции без участия А и без образования А | В1 + В2 ® В + С B1 + B1 ® B, B2 + B2 ® C, В1 + В ® C и т.п. | |
| 4. Нецепные реакции с участием новых молекул А | В1 + А ® В + С | 2 – 3 |
| 5. Цепные реакции без участия молекул А | В1 + В ® D + В2 В2 + С ® D + В1 | >1 или >>1 |
| 6. Цепные реакции с участием молекул А | В1 + А ® В + В2 В2 + А ® С + В1 | >1 или >>1 |
В таблице 23.2 представлены возможные вторичные процессы и зависимость квантового выхода от характера реакции (В1 и В2 – активные частицы, В, С, D – устойчивые молекулы, отличные от А).
Как следует из таблицы, большой квантовый выход характерен для тех фотохимических реакций, в которых могут протекать цепные процессы (разветвленные или неразветвленные). Малый квантовый выход свидетельствует о прохождении процессов рекомбинации или реакций с регенерацией молекул А. Если g равно небольшому числу и слабо зависит от условий опыта, то вероятно, что происходит быстрая и полная диссоциация на устойчивые молекулы или радикалы, реагирующие только по процессам 3 и 4. Вообще же представление о механизме конкретной реакции составляется на основании зависимости квантового выхода от условий опыта: от концентрации или давления реагирующих веществ и присутствия инертных добавок; интенсивности светового потока; длины волны; температуры; размеров и материалов стенки сосуда.
23.3. Химические реакции под действием излучений больших энергий
23.3.1. Общие понятия о радиационных реакциях
Раздел физической химии, в котором исследуются химические реакции, протекающие под действием излучений с большими энергиями, называется радиационной химией. К излучениям большой энергии относят различные виды радиоактивных лучей, нейтроны, электроны, положительно и отрицательно заряженные ионы и лучи с энергией больше 50 эВ – рентгеновские и g-лучи. Эта энергия значительно больше энергии квантов света, которая не превышает 12 эВ. Химические реакции под действием излучений высокой энергии называют радиолизом.
Первые наблюдения действия излучения были проведены еще в 1896 г. Беккерелем, который обнаружил почернение фотографической пластинки под действием калийуранилсульфата. Но интенсивные исследования таких реакций начались только в связи с развитием атомной энергетики и созданием ядерного оружия.
Источником энергии для активации молекул или их превращения в атомы и радикалы может быть излучение радиоактивных атомов, которые являются отходами при работе ядерных реакторов. При деления ядра 235U получаются два новых ядра с близкими атомными массами. Атомы продуктов деления нестабильны и подвергаются дальнейшим превращениям в процессах b-распада. Некоторые из вновь образовавшихся атомов находятся в возбужденном состоянии и переходят в основное состояние с излучением одного или нескольких g-квантов. Максимальная энергия b-частиц продуктов деления достигает 3,5 МэВ, а g-излучения – 3,8 МэВ.
Облучения можно также проводить внутри активной зоны атомного реактора. Около 10% энергии, которая выделяется в реакторе, приходится на b- и g-излучения. Источниками излучения в реакторах являются продукты деления атомного горючего и потоки горючего во внешних контурах реакторов, которые работают на жидком горючем, – растворы уранилнитрата или уранилсульфата.
В качестве источников излучения используют некоторые искусственные радиоактивные изотопы, которые получают при облучении веществ нейтронами в ядерных реакторах. Например, довольно распространенным источником излучения является изотоп 60Со с периодом полураспада 5,3 года. Энергия g-лучей 60Со равняется 1,17 и 1,33 МэВ. Используют также изотоп 137Cs как источник g-излучения с энергией 0,6616 МэВ, на которое приходится 82% всей энергии излучения, остальная энергии приходится на b-излучения. Период полураспада 137Cs составляет 30 лет. В качестве источника быстрых электронов со средней энергией 0,205 МэВ используют изотоп 90Sr с периодом полураспада 28 лет.
Кроме того, в качестве источников излучений высокой энергии используют протоны, дейтроны, a-частицы, пучки быстрых электронов g-излучение мощных рентгеновских трубок и т.п..
Энергия частичек, которые используют в радиационной химии, во много раз больше энергии валентных электронов веществ, которые принимают участие в химической реакции. Поэтому, в отличие от фотохимических реакций, первичный акт взаимодействия излучения высокой энергии с веществом не имеет выборочного характера. В первичном акте вещество ионизируется, возникают разнообразные свободные радикалы, возбужденные молекулы и атомы. Поглощение ионизирующих излучений зависит от порядкового номера элемента, который поглощает. Первичные продукты взаимодействия получаются вдоль путей (треков) ионизирующих частичек.
Продукты взаимодействия излучений высокой энергии с данным веществом мало зависят от вида или энергии излучения. Все виды излучения высоких энергий приводят к качественно одинаковым химическим эффектам. Но излучения разных типов и энергий теряют свою энергию в веществе с разной скоростью. Поэтому плотность первичных активных продуктов зависит от типа излучения. Эта зависимость в особенности проявляется при ионизации жидкостей вследствие затруднения диффузии активных продуктов из треков. В газах активные продукты довольно легко выходят из треков, поэтому разные типы излучений обычно не влияют на выход радиационных реакций.
Электроны, которые выбиваются из атомов или молекул в первичных актах ионизации, могут при столкновенье с атомами и молекулами снова вызвать ионизацию или возбуждение. Если вторичные электроны имеют высокую энергию, то они образовывают собственные треки (d-лучи), которые отходят от первичных. При маленьких энергиях вторичных электронов (< 100 эВ) их пробег в жидкостях и твердых телах маленький, поэтому продукты вторичной ионизации расположены очень близко к первичным продуктам и образуют так называемые шпуры, которые обычно содержат 2 – 3 пары ионов и несколько возбужденных молекул. Если плотность ионизации большая, то шпуры могут быть расположены близко и частично перекрываться, образуя колонны ионизации. Таким образом, в отличие от фотохимических реакций, в которых возбужденные молекулы равномерно распределяются вдоль плоскости, перпендикулярной направлению света, для радиационно-химических реакций характерным является неравномерное распределение активных частичек в объеме вещества, которое облучается.
В фотохимических реакциях вторичные реакции в большинстве случаев являются чисто химическими (реакциями радикалов). В отличие от них, вещества, которые получаются под действием радиации, испытывают дальнейшее действие радиации. Поэтому, кроме химических, могут наблюдаться процессы взаимодействия с веществом электронов, которые образовались в первичном акте, ядер отдачи или квантов меньшей энергии.
23.3.2. Первичные процессы
Прохождение излучения через вещество приводит к потере его энергии. Пока энергия частичек и квантов излучения больше энергии ионизации атомов и молекул, она расходуется, главным образом, на их ионизацию.
Торможение a-частиц в веществе в основном вызовет их взаимодействие с электронами. a-Частицы захватывают электроны и образовывают однозарядные ионы и электронейтральные атомы гелия. Но вследствие огромной скорости частиц присоединенные электроны могут отщепляться, и такой процесс повторяется многократно. Одновременно из атомов и молекул поглощающей среды получаются ионы. На один акт образования пары ионов в воздухе при 15 оС и 105 Па a-частицазатрачивает в среднем 33 эВ энергии. Электроны, которые выбиваются a-частицами из атомов и молекул, могут иметь большую энергию и вызвать ионизацию других атомов и молекул.
b-Лучи имеют большую проникающую способность по сравнению с a-частицами, но значительно меньшую, чем g-лучи. При прохождении через вещество b-лучи выбивают из атомов и молекул электроны, что приводит к образованию положительно заряженных ионов. b-Частица с энергией 1 МэВ образует в воздухе около 30000 пар ионов, в то время как a-частица с такой же энергией – около 200000 пар ионов. Практически b-излучение можно использовать, когда нужно создать ионизацию только в поверхностном или тонком слое вещества, или при осуществлении цепной реакции в газе. Когда нужно, чтобы излучение проникало на большую глубину, например, для осуществления реакций в жидких и твердых телах, применяют g-лучи.
Поглощение g-лучей веществом может проходить по разным механизмам. Если энергия g-квантов составляет порядка 10 КэВ (l > 0,15 нм), то при взаимодействии фотона с атомом наблюдается фотоэлектрический эффект. Кинетическая энергия выбитого электрона равняется энергии фотона, за исключением энергии, которая необходима для удаления электрона из атома. Фотон при этом полностью поглощается, следовательно, такой процесс не изменяет энергию фотонов проходящего пучка, а только уменьшает их общее количество. При увеличении энергии фотонов пучка важную роль начинает играть эффект Комптона. При столкновении с атомным электроном фотон испытывает упругое рассеяние. При этом энергия кванта распределяется между электроном отдачи и фотоном рассеяния. Образующийся электрон отдачи, в свою очередь, вызывает ионизацию вещества.
При эффекте Комптона общее количество фотонов не изменяется, но они теряют энергию, которая приводит к снижению их частоты и к изменению направления их движения. Эти рассеянные фотоны также могут вызвать ионизацию вещества.
При поглощении g-квантов с энергией больше 1,02 МэВ (l < 10–3 нм) возрастает вероятность процесса образования пар частичек. Электромагнитная энергия фотона при этом превращается в энергию возникающей электронно-позитронной пары. Как и при фотоэлектрическом эффекте, при образовании пары фотон полностью исчезает.
Рентгеновские лучи отличаются от g-квантов только меньшей частотой, следовательно, и меньшей энергией. Их действие на вещество аналогично действию g-лучей небольшой энергии.
Нейтроны при прохождении через вещество сталкиваются и взаимодействуют только с ядрами атомов. Если ядро не захватывает нейтрон, то природа ядра не изменяется. Но нейтрон может выбить атом из молекулы. Импульс, который получает ядро выбитого атома, может быть настолько большим, что ядро выйдет из своей электронной оболочки. При небольших энергиях нейтронов скорость выбитого атома небольшая, и ядро сохраняет свою электронную оболочку, которая может перейти в возбужденное состояние. Нейтроны также могут быть захвачены ядрами (получаются изотопы) или выбить из ядра составные частицы и привести к образованию новых элементов.
23.3.3. Количественные характеристики
радиационно-химических преобразований
В качестве количественной оценки химических процессов под действием облучения используют число молекул, которые прореагировали при поглощении 100 эВ энергии облучения (G) или числом электронвольт, которые вызовут преобразование одной молекулы вещества – 100/G. Величину G называют радиационно-химическим выходом.
Иногда в радиационной химии используют понятие ионный выход– отношения числа молекул, которые прореагировали, к числу пар ионов, которые возникают при той же поглощенной дозе излучения. Это понятие можно употреблять только для таких реакций в газовой фазе, для которых можно определить число пар ионов, которые возникают, по току насыщения.
По радиационно-химическому выходу реакции разделяют на три группы:
1) Реакции с G = 1–10. К этой группе принадлежат медленные реакции с высоким энергетическим барьером; во многих случаях эти реакции эндотермические. Например, к таким реакциям относятся реакции разложения углеводородов при невысоких температурах, реакция азота с водородом, разложение воды и др.
2) Реакции с 10 < G < 20. Эти относительно быстрые реакции с невысоким энергетическим барьером, в ряде случаев экзотермические. Это, например, реакции образования озона в жидком кислороде, распада СО2, NО2.
3) Реакции с G > 20. Обычно это цепные реакции. Примером таких реакций могут быть реакции алкилирования парафиновых и ароматических углеводородов олефинами, крекинг углеводородов при 400 оС. Для некоторых из этих реакций (хлорирование углеводородов, некоторые реакции полимеризации) G = 104 – 106.
Радиационно-химический выход представляет собой среднюю величину. По определению,
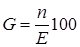 , (23.11)
, (23.11)
где n – число молекул продукта реакции, которые образовались за время t, Е – поглощенная энергия излучения в еВ.
При t ® 0 радиационно-химический выход приближается к истинному радиационно-химическому выходу g:
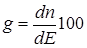 . (23.12)
. (23.12)
Связь между средним и истинным выходами устанавливается соотношением
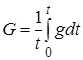 . (23.13)
. (23.13)
Исходя из определения скорости реакции v (уравн. (20.1)), можно записать:
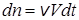 , (23.14)
, (23.14)
где V – объем реакционного пространства.
Если облучения проводят источником с постоянной активностью А, то поглощенная энергия
dЕ = aANdt, (23.15)
где a = ds (d – геометрический фактор, который зависит от конфигурации и взаимного расположения источника излучения и реакционного сосуда; s – коэффициент, который характеризует свойства среды); N – количество молекул в поглощающей среде.
После подстановки уравнений (23.14) и (23.15) в (23.12) получим:
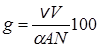 . (23.16)
. (23.16)
Мощность дозыР равняется энергии, которая поглощается в единицу времени:
P = d/dt = aAN, (23.17)
поэтому уравнение (23.16) можно записать также в виде:
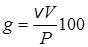 . (23.18)
. (23.18)
Отсюда видно, что истинный выход реакции прямо пропорционален скорости реакции.
После подстановки уравнения (23.16) в уравнение (23.13) получим:
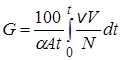 . (23.19)
. (23.19)
Если v = const (это условие выполняется для реакций нулевого порядка и приближенно выполняется при малых степенях превращения), а также постоянным остается реакционный объем V, то
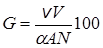 . (23.20)
. (23.20)
Если продукты реакции выводятся из зоны облучения, то
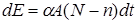 , (23.21)
, (23.21)
тогда
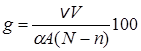 (23.22)
(23.22)
и, соответственно,
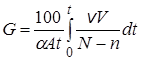 . (23.23)
. (23.23)
Все приведенные соотношения получены в предположении однородного распределения активных частичек в зоне облучения.
Изменения в системе под действием разных излучений зависят от поглощенной энергии. Энергию любого излучения, которая поглощается единицей массы вещества, называют поглощенной дозойизлучения, или просто дозой излучения. За единицу дозы излучения в СИ принимается джоуль на килограмм (Дж·кг–1). Внесистемною единицей поглощенной дозы является рад (1 рад = 0,01 Дж·кг–1). Рад – это единица поглощенной дозы, при которой количество поглощенной энергии в 1 г любого вещества составляет 100 эрг, независимо от вида энергии ионизирующей радиации. Производными единицами являются миллирад (1 мрад = 10–3 рад = 0,1 эрг·г–1) и микрорад (1 мкрад=10–6 рад = 0,0001 эрг·г–1).
В результате поглощения определенного излучения проходит изменение физических или химических свойств поглощающего вещества. Поэтому поглощенную дозу можно измерять по тем эффектам, к которых приводит излучение. Чаще всего под действием излучения происходит ионизация вещества. Плотность ионизации в течение пробега частиц неодинакова, поэтому доза на разных участках вещества будет разной. Вследствие этого используют понятие о средней поглощенной дозе:
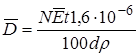 рад, (23.24)
рад, (23.24)
где N – количество частиц, попадающих на 1 см2 поверхности вещества, которое облучается, в 1 с; 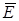 – средняя энергия этих частиц в МэВ; t – время облучения, с; 1,6·10–6 – термический эквивалент единицы МэВ (1 МэВ = 1,6·10–6 эрг); 100 – энергетический эквивалент единицы рад (1 рад = 100 эрг·г–1); d –длина свободного пробега ионизирующей частицы в облучаемом веществе, см; r – плотность вещества, г·см–3.
– средняя энергия этих частиц в МэВ; t – время облучения, с; 1,6·10–6 – термический эквивалент единицы МэВ (1 МэВ = 1,6·10–6 эрг); 100 – энергетический эквивалент единицы рад (1 рад = 100 эрг·г–1); d –длина свободного пробега ионизирующей частицы в облучаемом веществе, см; r – плотность вещества, г·см–3.
Для характеристики дозы излучения по эффекту ионизации используется так называемая экспозиционная дозаизлучения. Она определяет энергию излучения, превращенную в кинетическую энергию заряженных частиц в единице массы атмосферного воздуха. За единицу экспозиционной дозы рентгеновского и g-излучений принимается кулон на килограмм (1 Кл·кг–1) – это доза, при которой сопряженная с этим излучением корпускулярная эмиссия образовывает в килограмме сухого атмосферного воздуха ионы, которые несут заряд 1 кулон электричества каждого знака. Внесистемной единицей экспозиционной дозы фотонного излучения (рентгеновского и g-излучений) является рентген (Р), равный 2,58·10-4 Кл·кг–1.
Рентген – это единица экспозиционной дозы рентгеновского и g-илучений, при которой сопряженная с этим излучением корпускулярная эмиссия в 0,001293 г воздуха (1 см3 при 0 оС и давления 1,01323.105 Па) образовывает ионы, которые имеют заряд в одну электростатическую единицу каждого знака. Производными единицами являются миллирентген (1 мР = 10–3 Р) и микрорентген (1 мкР = 10–6 Р).
Величина заряда однозарядного иона составляет 4,8·10–10 единиц СГСЕ (заряд электрона), поэтому 1 Р соответствует образованию 1/4,8·10–10 = 2,08·109 пар ионов в 1 см3 воздуха.
Энергия, которая расходуется на образование одной пары ионов равняется в среднем 34 эВ; итак, доза в 1 Р соответствует поглощению энергии
Е=2,08·109·34 = 7,07.1010 эВ = 0,114 эрг·см3,
или для 1 г воздуха
Е = 0,114/0,001293 = 87,7 эрг·г–1.
Итак, при экспозиционной дозе 1 Р поглощенная энергия в воздухе равняется 87 эрг·г–1, а поглощенная доза равняется 0,87 рад. Значения 0,114 эрг·см–3 и 87,7 эрг·г–1 называют энергетическими эквивалентами рентгена.
Применение рентгена как единицы дозы разрешается для измерения экспозиционной дозы до 3 МэВ. Использования единицы экспозиционной дозы по степени ионизации воздуха удобно тем, что эту степень ионизации легко измерять и, кроме того, энергии, которые поглощаются 1 см3 живой ткани и 1 см3 воздух, пропорциональны. Поглощенная энергия в воде и мышечной ткани незначительно отличается от поглощенной энергии в воздухе. Это объясняется тем, что эффективные атомные номера воды и мышечной ткани мало отличается от среднего атомного номера воздуха. Поглощенная доза излучения и экспозиционная доза рентгеновского и g-излучений за единицу времени называются мощностью поглощенной дозы и мощностью экспозиционной дозырентгеновского и g-излучений.
За единицу мощности поглощенной дозы излучения и мощности экспозиционной дозы используют, соответственно, ватт на килограмм (Вт·кг–1) и ампер на килограмм (А·кг–1). Один А·кг–1 – это мощность экспозиционной дозы фотонного излучения, при которой за время 1 с экспозиционная доза повышается на 1 Кл·кг–1. Внесистемными единицами мощности поглощенной дозы излучения и мощности экспозиционной дозы рентгеновского и g-излучений являются рад в секунду (рад·с–1) и рентген в секунду (Р·с–1).
Для характеристики распада радиоактивных веществиспользуют единицы активности. За единицу активности принимается один распад в секунду (расп/с). Внесистемной единицей активности радиоактивного изотопа является Кюри (Ки). Эта единица определяется количеством радиоактивного вещества, в котором происходит 3,700·1010 распадов в секунду. 1 Кюри отвечает 0,66 мм3 радона при 0 оС и 1,01323·105 Па, который находится в равновесии с 1 г радия. Производными единицами являются милликюри (1мКи = 10–3 Ки = 3,7.107 расп/с) и микрокюри (1мкКи = 10–6 Ки = 3,7·104 расп/с).
Иногда для характеристики активности источника g-излучения используют в качестве единицы грамм-эквивалент радия – массу радиоактивного вещества, которое при одинаковых геометрических условиях создает такую же дозу, как и один грамм радия в равновесии со своими продуктами распада.
Один миллиграмм радия, который находится в равновесии с короткоживущими продуктами распада и содержится в платиновом фильтре толщиной 0,5 мм, имеет, по определению, активность 1 мКи.
Гамма-эквивалент (g-эквивалент) препарата равняется 1 миллиграмм-эквиваленту радия, если g-излучение в тождественных условиях измерения создает такую же ионизацию как и 1 мг (мкКи) радия в равновесии с продуктами распада в платиновом фильтре толщиной 0,5 мм.
Для точечного источника с активностью с мКи экспозиционная доза излучения D (в Р) за время t (ч) на расстоянии R (см) равняется:
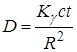 , (23.25)
, (23.25)
где Кg – g-постоянная изотопа, которая показывает мощность экспозиционной дозы g-излучения в Р/ч на расстоянии 1 см от точечного источника с активностью 1 мКи.
Значения g-постоянных некоторых источников g-лучей приведены ниже:
Вещество 226Ra 60Co 137Cs 192Ir
Kg , Р/ч 8,4 13,5 4,2 5,47
Интенсивность излучения или дозы излучения можно определять непосредственно с помощью абсолютных методов, например, по ионизации в газе; калориметрически; по заряду, который переносится пучком заряженных частиц с известной энергией.
Абсолютные методы измерений сложны, они требуют специального дорогого оборудования (нормальные воздушные камеры, калориметры, масс-спектрометры и т.п.). Поэтому на практике используют вторичные дозиметры, которые позволяют сравнивать измеренные значения с эталонными, например, наперсточные ионизационные камеры, химические дозиметры.
Химические дозиметры должны удовлетворять определенным требованиям: радиационно-химический выход должен быть пропорциональным поглощенной дозе излучения в широком интервале доз; химические изменения в системе в измеренном интервале не должны зависеть от мощности дозы; показания дозиметра не должны зависеть от энергии, линейных потерь энергии излучения и температуры.
В химических дозиметрах используют ферросульфатную систему (окисление двухвалентных ионов железа в трехвалентные под действием излучения), церийсульфатную систему (радиационно-химическое восстановление четырехвалентных ионов церия в трехвалентные) и некоторые другие.
В качестве дозиметров можно использовать специальное стекло, окраска которого изменяется в зависимости от поглощенной дозы, или красители, которые выцветают или изменяют цвет под действием излучения.
23.3.4. Вторичные процессы
Активные частицы, которые возникают под действием излучений в первичных процессах ионизации и диссоциации молекул (ионы, атомы, радикалы, фотоны с меньшей энергией, фотоэлектроны и т.п.), вступают во вторичные процессы. Элементарные процессы разнообразны, могут проходить в разной последовательности, поэтому механизм радиационно-химических преобразований очень сложный и точно установлен лишь для некоторых реакций.
Если действие излучения начинается с ионизации молекулы, то наиболее возможен процесс однократной ионизации исходной молекулы:
А ÙÙÙ3 А+ + е–,
где стрелка ÙÙÙ3 указывает на поглощение определенного излучения.
Далее возможен процесс нейтрализации с образованием возбужденной молекулы А*:
А+ + е– ® А*
Наряду с этим вырванный при ионизации электрон может быть захвачен другой молекулой М (М может быть такой же молекулой А или другой):
М + е– ® М–
Возможны также реакции
А + е– ® В+ + С– + е–
Если ион А+, который образовался в исходной реакции, приобретает потом более устойчивую конфигурацию, то нейтрализация может осуществляться при взаимодействии с ионом противоположного знака М–:
А+ + М– ® А* + М
Возбужденная молекула А* может распадаться на свободные радикалы или атомы R· и Х или на более мелкие стабильные молекулы В и С:
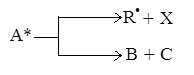
В жидкой фазе более вероятным является второй процесс перестройки молекулы.
Положительный ион может отрывать электрон от нейтральной молекулы (перенесение заряда):
А+ + В ® А + В+
Потенциал ионизации нейтральной молекулы должен равняться или быть меньшим потенциала ионизации новой молекулы, которая образовалась из иона. Возможны ионно-молекулярные реакции типа
А+ + В ® С+ + D
Ион А+ может непосредственно расщепляться двумя способами:
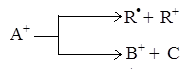
В этом случае первая из возможных реакций приводит к образованию свободного радикала и иона этого радикала, а вторая реакция – к образованию молекулы и молекулярного иона. Первая реакция требует больших затрат энергии.
Свободные радикалы и атомы, которые возникают, могут инициировать цепные реакции. Например, в случае полимеризаци возможны процессы:
R· + A ® RA·
RA· + A ® 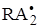
…………………
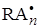 + A ®
+ A ® 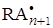
Таким образом можно под влиянием излучения вызвать, например, полимеризацию акрилонитрила в воде.
Под действием g-лучей во многих полимерах, в частности в полиэтилене, увеличивается количество поперечных связей, которые повышают механическую прочность полимера и делают его более стойким к воздействию растворителей и высоких температур. Образование поперечных связей – это вторичный процесс, который проходит вследствие отщепления боковых цепей и приводит к образованию свободных радикалов. Они взаимодействуют с соседними молекулами и образовывают с ними химические связи.
Облучение полимеров может создавать вдоль полимерной цепи свободные радикалы. Если облученный полимер погрузить в среду с мономером другой природы, то происходит процесс присоединения мономера к полимеру – радиационная прививка.
Во многих случаях при облучении разрываются главные связи, что приводит к уменьшению средней молекулярной массы – происходит деструкция полимеров. Такое явление наблюдается, например, в полиизобутилене. Опытами установлено, что ароматические соединения более стойки к воздействию излучений по сравнению с алифатическими.
При образовании ионов возможны ионно-молекулярные взаимодействия, которые проходят, как правило, с очень низкими энергиями активации. Примером реакций, для которых большое значение имеет первичная ионизация, являются реакции CO2 + H2, N2 + O2, N2 + H2, H2 + Br2, распад HBr и др. Первично возбужденные молекулы играют основную роль в реакциях синтеза озона, окисления углерода и СО, распада N2O, NO, NO2. Реакция разложения аммиака является примером реакций промежуточного типа, для нее первичные процессы ионизации и процессы возбуждения имеют приблизительно одинаковое значение. В реакциях разложения СО и СО2 и паров Н2О значительную роль играют процессы рекомбинации атомов и радикалов. Радиационно-химические реакции, в которых главную роль играют свободные радикалы, проходят как цепные с высокими энергетическими выходами: 102 – 105 молекул на 100 эВ поглощенной энергии. Примерами таких реакций могут быть реакции окисления и хлорирования углеводородов.
Интересные результаты получены при хлорировании углеводородов. Хлорирование бензола под действием g-лучей и ультрафиолетового света идет одинаково. В то же время в толуоле под действием УФ-света хлорируется метильная группа, а при g-облучении – бензольное кольцо. Таким образом, наблюдается избирательность действия разных типов излучения на углеводороды.
Радиационно-химические реакции в конденсированной фазе имеют ряд особенностей по сравнению с реакциями в газовой фазе. Возрастание плотности вещества при переходе от газа к жидкости увеличивает удельную ионизацию. В то же время облегчается возможность дезактивации и сокращается продолжительность пребывания в возбужденном состоянии. Процессы рекомбинации ионов и радикалов облегчаются близостью молекул жидкости, которые играют роль третьей частички. Кроме того, возможна непосредственная рекомбинация тех частей молекулы, которые получаются вследствие прямой диссоциации.
Такое явление наблюдается и в газах для молекул с большой молекулярной массой. При этом вероятность рекомбинации радикалов, возбужденных молекул и ионов возрастает с увеличением молекулярной массы. Чем больше молекула, тем больше степеней свободы она имеет, тем большее время молекула может находиться в состоянии с большим запасом энергии за счет распределения этой энергии по степеням свободы. Кроме того, чем больше молекула, тем меньше различие между атомной конфигурацией иона и атомной конфигурацией нейтральной молекулы и тем более возможным будет процесс нейтрализации иона без последующего разложения.
В растворах в полярных жидкостях на стабильность образованных ионов и вероятность их преобразования в радикалы значительное влияние оказывает сольватация. Различие между радиационно-химической активностью вещества в жидком и газообразном состояниях обусловлено не различием первичных физических процессов в этих двух состояниях, а различием во вторичных процессах, которые идут за первичными актами возбуждения и ионизации.
23.3.5. Радиолиз водыи водных растворов
При действии излучений на воду проходят такие суммарные реакции:
2Н2О ® Н2О2 + Н2
Н2О2 ® Н2О + 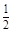 О2
О2
Значительное количество переоксида водорода получается только в том случае, когда вода содержит растворенный кислород. В отсутствии кислорода приведенные реакции проходят при действии g-излучения с очень маленьким выходом. Можно считать, что вода, которая не содержит растворенный кислород, практически не разлагается при действии рентгеновских, g- и b-излучений. При действии a-лучей количество пероксида водорода одинаково как в присутствии кислорода, так и без него.
Первичное химическое действие излучения приводит к образованию Н и ОН· по схеме:
Н2О ÙÙÙ3 Н2О+ + е–
Н2О+ + aq ® Н+aq + ОН·
е– + Н2О + aq ® ОН–aq + Н
е– + Н2О + aq ® ОН–aq + Н
 Н2О ÙÙÙ3 ОН· + Н
Н2О ÙÙÙ3 ОН· + Н
Пространственное распределение этих радикалов сразу же после их образования зависит от вида инициирующего излучения. При прохождении a-частиц, протонов малой энергии или электронов малой энергии радикалы получаются вдоль треков этих частиц и в больших количествах. Эти радикалы реагируют друг с другом, что приводит к образованию водорода, пероксида водорода и воды:
Н + Н ® Н2
ОН· + ОН· ® Н2О2
Н + ОН· ® Н2О
Таким образом, можно считать, что под действием излучений проходит две реакции:
2Н2О ÙÙÙ3 Н2О2 + Н2
Н2О ÙÙÙ3 Н + ОН·
Аналогичные реакции происходят в воде и при действии a-лучей, но в незначительной степени, если вода не содержит растворенный кислород. Радикалы, которые образовались в последней реакции, способные реагировать с растворенными веществами.
В чистой воде под действием излучений возможные также реакции
Н + Н2О2 ® Н2О + ОН·
ОН· + Н2 ® Н2О + Н
Эти реакции можно рассматривать как обратные цепные реакции, которые приводят к уничтожению продуктов разложения воды. Для пероксида водорода возможна также еще одна реакция, которая тормозит его распад:
Н2О2 + ОН· ® Н2О + 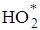
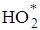 + Н ® Н2О2
+ Н ® Н2О2
Добавление в воду многих веществ вызывает рекомбинацию радикалов и может тормозить обратные реакции. Растворенные вещества окисляются или восстанавливаются в реакциях с радикалами гидроксила, атомами водорода и молекулами пероксида водорода. Например, в присутствии ионов брома могут происходить реакции:
Br– + OH· ® Br· + OH–
Br + Н ® Br– + H+
Присутствие кислорода в растворе приводит к образованию свободных радикалов 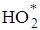 по реакции:
по реакции:
Н + О2 ® 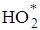
Эти радикалы реагируют с пероксидом водорода и гидроксилом с образованием кислорода:
Н2О2 + 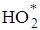 ® Н2О + OH· + О2
® Н2О + OH· + О2
OH· + 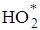 ® Н2О + О2
® Н2О + О2
С другой стороны, участие радикалов 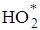 в реакциях может приводить к образованию Н2О2:
в реакциях может приводить к образованию Н2О2:
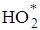 +
+ 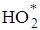 ® Н2О2 + О2
® Н2О2 + О2
Н + 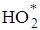 ® Н2О2
® Н2О2
Эти реакции оказывают содействие образованию пероксиду водорода под действием g-излучений на воду, которая содержит растворенный кислород.
Детальной механизм радиолиза воды полностью не выяснен. Чтобы вообразить всю сложность возможных процессов, которые проходят под действием излучений высоких энергий, схематически рассмотрим возможные элементарные процессы при радиолизе воды.
Первичный процесс ионизации воды приводит к появлению вторичных электронов, при столкновении которых с молекулами воды в зависимости от скорости может проходить дальнейшая ионизация молекул воды с образованием Н2О+, а также диссоциативная ионизация или возбуждение молекул. Электроны, которые теряют скорость, могут рекомбинировать с ионом Н2О+, вследствие чего получается два радикала
Н2О+ + е– ® Н + ОН·
или проходит диссоциация
Н2О+ ® Н+ + ОН·
Электроны могут также вступать в реакции:
е– + Н3О+ ® Н2О + Н
е– + Н2О ® ОН– + Н
е– + Н+ ® Н
или гидратироваться:
е– + nН2О ® 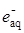
Время жизни гидратированного электрона составляет ~ 10–5 с. Он может вступать в реакции:
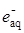 + ОН· ® ОН–aq
+ ОН· ® ОН–aq
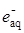 + Н+ ® Нaq
+ Н+ ® Нaq
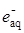 + О2 ®
+ О2 ® 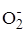 aq
aq
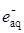 + Н2О2 ® ОН· + ОН–aq
+ Н2О2 ® ОН· + ОН–aq
Свободные атомы и радикалы, которые возникают в этих реакциях, могут рекомбинировать по реакциям:
ОН· + ОН· ® Н2О2
Н + Н ® Н2
Н + ОН· ® Н2О
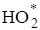 +
+ 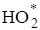 ® Н2О2 + О2
® Н2О2 + О2
Кроме того, атомы и радикалы могут принимать участие в реакциях:
Н + Н2О2 ® Н2 + 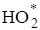
ОН· + Н2О2 ® Н2О + 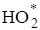
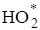 L Н+ +
L Н+ + 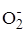
В ходе реакции могут получаться триплетные молекулы воды, которые вступают в реакцию
Н2О* + Н2О ® Н2 + Н2О2
При радиолизе воды возможный процесс
Н2О ® Н + ОН+ + е–,
а пероксид водорода может электролитически диссоциировать:
Н2О2 ® 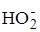 + Н+
+ Н+
Главными процессами, которые определяют выход конечных молекулярных продуктов радиолиза воды, являются реакции рекомбинации радикалов в шпурах. Так, радиационно-химический выход при разложении жидкой воды равняется ~ 4. Он приблизительно втрое меньше, чем в газовой фазе, за счет реакции рекомбинации Н + ОН·, которая проходит в шпурах вследствие эффекта клетки.
Образованием радикалов Н, ОН·, 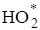 можно объяснить окислительно-восстановительные реакции, которые проходят в растворах многих веществ под действием излучений. Например, при облучении кислых водных растворов сульфата двухвалентного железа в отсутствии кислорода воздуха протекает реакция
можно объяснить окислительно-восстановительные реакции, которые проходят в растворах многих веществ под действием излучений. Например, при облучении кислых водных растворов сульфата двухвалентного железа в отсутствии кислорода воздуха протекает реакция
Fe2+ + OH· ® Fe3+ + OH–
В насыщенном воздухом растворе получаются радикалы 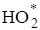 , которые реагируют с ионами двухвалентного железа по реакции:
, которые реагируют с ионами двухвалентного железа по реакции:
Fe2+ + 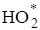 ®
® 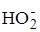 + Fe3+
+ Fe3+
Кроме того, окислителем может быть и пероксид водорода, который получается в растворе.
Бихромат калия в кислой среде восстанавливается под действием рентгеновских и g-лучей. Растворы КІО3 восстанавливаются при действии a-излучения и рентгеновских лучей.
Облучение водных растворов бензола в отсутствии кислорода приводит к образованию фенола и дифенила по схеме:
С6Н6 + ОН· ® С6Н5· + Н2О
С6Н5· + ОН· ® С6Н5ОН
С6Н5· + С6Н5· ® С6Н5С6Н5
В присутствия растворенного в воде кислорода выход фенола возрастает в несколько раз. Это объясняется тем, что кислород, образуя в воде радикалы 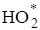 , удаляет из реагирующей смеси атомы Н и этим замедляет рекомбинацию атомарного водорода со свободным гидроксилом и с фенильными радикалами, которая приводит к образованию воды и бензола. Кроме того, радикал
, удаляет из реагирующей смеси атомы Н и этим замедляет рекомбинацию атомарного водорода со свободным гидроксилом и с фенильными радикалами, которая приводит к образованию воды и бензола. Кроме того, радикал 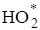 при взаимодействии со свободным фенилом образует гидропероксид фенола, который при разложении превращается в фенол.
при взаимодействии со свободным фенилом образует гидропероксид фенола, который при разложении превращается в фенол.
Обнаружено очень интересное явление, когда одно растворенное вещество защищает от разложения под действием излучений другое вещество. Например, добавление к водному раствору ацетона муравьиной кислоты в количестве, не меньшей одной десятой от количества ацетона, практически полностью защищает ацетон от разложения рентгеновскими лучами. Это явление особенно важно для биохимических систем и используется при разработке средств защиты человека от действия излучений.
| <== предыдущая лекция | | | следующая лекция ==> |
| Теорема Умова - Пойнтинга | | | Волновая поверхность |
Дата добавления: 2015-12-16; просмотров: 3834;
