Микроскопические методы исследования морфологии бактерий и грибов
ПРИГОТОВЛЕНИЕ ПРЕПАРАТОВ
ДЛЯ МИКРОСКОПИЧЕСКОГО ИССЛЕДОВАНИЯ
Для приготовления препарата исследуемый материал берут из пробирки, колбы или чашки Петри бактериологической петлей или стерильной пипеткой. В некоторых случаях используют для этой цели препаровальные иглы.
Приготовление препарата для изучения микроорганизмов в нативном виде.
Метод «висячей капли». Препарат готовят на покровном стекле, в центре которого наносят одну каплю бактериальной культуры. Затем предметное стекло с лункой, края которой предварительно смазывают вазелином, прижимают к покровному стеклу так, чтобы капля находилась в центре лунки. Быстрым движением переворачивают препарат покровным стеклом вверх. В правильно приготовленном препарате капля должна свободно висеть над лункой, не касаясь ее дна или края.
Для микроскопии вначале используют малый сухой объектив 8Х, под увеличением которого находят край капли, а затем устанавливают объектив 40Х и исследуют препарат.
Метод «раздавленной» капли. На поверхность обезжиренного предметного стекла наносят каплю исследуемого материала или суспензию бактерий и покрывают ее покровным стеклом. Капля должна быть небольшой, не выходящей за край покровного стекла. Микроскопируют препарат с объективом 40Х.
После микроскопии препараты «раздавленной» капли или «висячей» капли опускают в дезинфицирующий раствор.
Приготовление фиксированных препаратов-мазков.
Для приготовления препарата на обезжиренное предметное стекло наносят каплю воды или изотонического раствора хлорида натрия, в которую петлей вносят исследуемый материал и распределяют его таким образом, чтобы получить тонкий и равномерный мазок. При таком распределении материала в мазке при микроскопии можно увидеть изолированные бактериальные клетки. Если исследуемый материал содержится в жидком виде, то его непосредственно наносят петлей на предметное стекло и готовят мазок. Мазки высушивают на воздухе или в струе теплого воздуха над пламенем горелки, не давая капле закипать.
Для фиксации мазка предметное стекло (мазком вверх) медленно проводят 3 раза через пламя горелки. Микроорганизмы при фиксации погибают, плотно прикрепляясь к поверхности стекла, и не смываются при дальнейшей обработке. Более длительное нагревание может вызвать деформацию клеточных структур. Мазки крови, мазки-отпечатки органов и тканей и в некоторых случаях мазки из культур микроорганизмов фиксируют погружением на 15-20 мин. в метиловый или этиловый спирт, смесь Никифорова, сулемовыйспирт и другие фиксирующие жидкости.

Рис. 1. Фиксация прапарата-мазка пламенем.
МЕТОДЫ ОКРАСКИ МАЗКОВ
Простой метод. Фиксированный мазок окрасить каким-либо одним красителем, например фуксином водным (1-2 мин) или метиленовым синим (3-5 мин), промыть водой, высушить и микроскопировать.
Сложные методы. Последовательно нанести на препарат определенные красители, различающиеся по химическому составу и цвету, протравы, спирты, кислоты и др. Это позволяет выявить определенные структуры клеток и дифференцировать одни виды микроорганизмов от других. Окрас методом Грама является сложным методом.
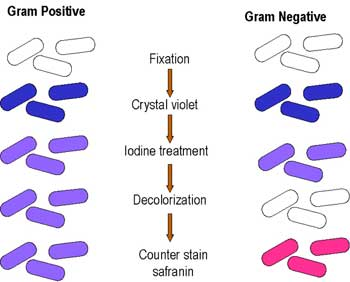
Рис.2. Окрас методом Грама (схема).
· На фиксированный мазок нанести карболово-спиртовой раствор генцианового фиолетового через полоску фильтровальной бумаги. Через 1-2 мин ее снять, а краситель слить.
· Нанести раствор Люголя на 1-2 мин.
· Обесцветить этиловым спиртом в течение 30-60 с до прекращения отхождения фиолетовых струек красителя.
· Промыть водой.
· Докрасить водным раствором фуксина в течение 1-2 мин, промыть водой, высушить и микроскопировать.
Грамположительные бактерии окрашиваются в темно-фиолетовый цвет, грамотрицательные - вкрасный.
ХАРАКТЕРИСТИКА КУЛЬТУРЫ ПО МОРФОЛОГИЧЕСКИМ И ТИНКТОРИАЛЬНЫМ ПРИЗНАКАМ
При микроскопии мазков изучают морфологические и тинкториальные свойства культур бактерий: форму, структуру и размер клеток, наличие спор, капсулы, жгутиков, пилей, расположение клеток относительно друг друга, цвет в соответствии с использованными методами окраски, наличие и характер подвижности.
| 
| 
|
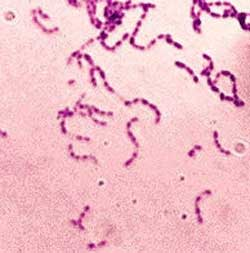
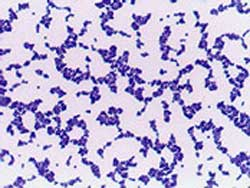
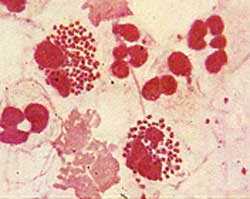
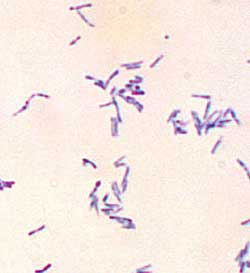
Рис. 5. Стрептококки (род. Streptococcus), стафилококки (род Staphylococcus), менингококки (род Neisseria).

| 
| 
|
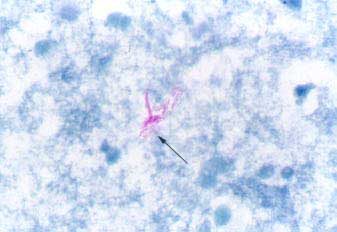
Рис. 6. Кишечная палочка (род. Escherichia), дифтерийная палочка (род Corynebacterium), микобактерии туберкулеза (род Mycobacterium).
Тема 5. Физиология бактерий и методы ее изучения. Бактериологически методы е исследования.
Содержание:
· Бактериологические методы исследования.
· Питательные среды.
· Методы посевов.
· Методы культивирования и выделения чистых культур бактерий.
· Идентификация бактерий.
БАКТЕРИОЛОГИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Бактериологические методы исследования - это совокупность методов изучения свойств микроорганизмов, определения их систематического положения. Для этого необходимо прежде всего изолировать отдельные виды микробов и вырастить их в виде так называемых «чистых культур», а затем идентифицировать, т.е. установить соответствие выделенных микроорганизмов видам, описанным в специальных определителях.
Колония- это популяция микробных клеток одного вида, сформировавшаяся в результате деления одной микробной клетки в условиях культивирования на плотной питательной среде при оптимальной температуре.
Чистая культура - масса клеток, состоящая из микроорганизмов, принадлежащих одному виду и полученных как потомство одной клетки. Чистую культуру обычно получают путем пересева на стерильную питательную среду клеток, взятых из отдельно стоящей колонии бактерий.
Культуральные свойствабактерий устанавливаются по морфологии колоний и особенности роста культуры на питательных средах.
Биохимические признаки (свойства)бактерий определяются набором ферментов, присущих определенному роду, виду, варианту.
ПИТАТЕЛЬНЫЕ СРЕДЫ ДЛЯ КУЛЬТИВИРОВАНИЯ БАКТЕРИЙ
Питательные среды предназначены для накопления, выделения, изучения и сохранения микроорганизмов.
По составу питательные среды могут быть синтетическими и натуральными.
По консистенции питательные среды могут быть жидкими, полужидкими (0,2-0,7% агара) и плотными (1,5-2% агара).
Различают питательные среды общего назначения (универсальные) и специальные питательные среды. Питательные среды общего назначения пригодны для выращивания многих видов микроорганизмов и применения в качестве основы для приготовления специальных питательных сред.Специальные питательные среды предназначены для избирательного культивирования определенных видов микроорганизмов, изучения их свойств и хранения.

Рис. 1. Плотные питательные среды в чашках Петри.
МЕТОДЫ ПОСЕВОВ
В зависимости от цели исследования, характера посевного материала и среды используют различные методы посева. Все они включают обязательную цель: оградить посев от посторонних микробов, поэтому посев производят в асептических условиях.
Для посевов на плотные питательные среды применяют шпатель, бактериологическую петлю, иглу, тампон. При посеве проводят петлей по поверхности среды линии, оставляя при этом клетки бактерий на среде. После посева чашки закрывают и переворачивают их вверх дном. Надписи на чашках делают со стороны дна, а на пробирках - в верхней части.
| 
| 
|
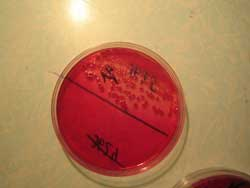
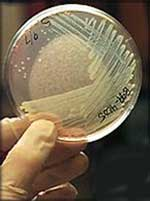
Рис. 2. Посев культуры на плотную питательную среду (слева); результат посева: видны колонии бактерий(в центре и справа).
При посеве на жидкую среду петлю слегка погружают в жидкость и растирают посевной материал на стенке пробирки, после чего смывают его средой.
МЕТОДЫ КУЛЬТИВИРОВАНИЯ
И ВЫДЕЛЕНИЯ ЧИСТОЙ КУЛЬТУРЫ БАКТЕРИЙ
Для успешного культивирования, помимо правильно подобранных сред и правильно произведенного посева, необходимы оптимальные условия: температура, влажность, аэрация (снабжение воздухом). Культивирование анаэробов сложнее, чем аэробов, для удаления воздуха из питательной среды используют различные способы.
Выделение отдельных видов бактерий (чистой культуры) из исследуемого материала, содержащего, как правило, смесь различных микроорганизмов, является одним из этапов любого бактериологического исследования. Чистой культурой микробовполучают из изолированной микробной колонии.
При выделении чистой культуры из крови (гемокультуры) ее предварительно «подращивают» в жидкой среде: 10-15 мл стерильно взятой крови засевают в 100-150 мл жидкой среды. Соотношение засеваемой крови и питательной среды 1:10 не случайно - так достигается разведение крови (неразведенная кровь губительно действует на микроорганизмы).
Дата добавления: 2015-12-08; просмотров: 3061;
