Тема 3. Учение об иммунитете
ИММУНОМИКРОБИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Серологические реакции в микробиологических и иммунологических лабораториях используют в двух целях:
· для серотипирования (сероидентификации) микроорганизмов, токсинов, антигена вообще с помощью известного антитела (иммунной диагностической сыворотки),
· для серодиагносики - определения природы антитела в сыворотке крови больного при бактериальных, вирусных, реже других инфекционных заболеваниях с помощью известного антигена (диагностикума).
Иммунные диагностические сыворотки - препараты, содержащие известные антитела для определения родовой, видовой и типовой принадлежности антигена.
Диагностикумы - препараты, содержащие известный антиген в виде взвеси живых или убитых бактерий, продуктов их расщепления, токсины, вирусы.
Правила забора крови для иммунологического исследования
Для серологического исследования у больного натощак берут кровь в количестве 5-6мл из локтевой вены при соблюдении правил асептики. Кровь ставят в термостат на 30-60 мин; образовавшийся кровяной сгусток отделяют от стенки стерильной стеклянной палочкой и оставляют в холодильнике на 18-20 ч. Отстоявшуюся сыворотку осторожно сливают в пробирку (стерильную); в случае примеси эритроцитов ее центрифугируют. Сыворотка может храниться в стерильных условиях в холодильнике до 1 мес. Для более длительного хранения ее замораживают при температуре от -20° до -70°С.
ИММУНОЛОГИЧЕСКИЕ РЕАКЦИИ ВЫЯВЛЕНИЯ СПЕЦИФИЧЕСКИХ АНТИГЕНОВ
Реакции агглютинации
В этих реакциях принимают участие антигены в виде частиц (микробные клетки, эритроциты и другие корпускулярные антигены), которые склеиваются антителами и выпадают в осадок.
Для постановки реакции агглютинации (РА) необходимы три компонента: 1) антиген (агглютиноген); 2) антитело (агглютинин) и 3) электролит (изотонический раствор натрия хлорида).
Аг + АТ + электролит = агглютинат
1. Постановка ориентировочной реакции агглютинации (РА) на стекле с целью идентификации бактерий кишечной группы.

Рис. 2. РА на стекле.
На предметное стекло наносят каплями:
1-ая капля: - агглютинирующая сыворотка к возбудителям дизентерии;
2-ая капля: - агглютинирующая сыворотка к возбудителям брюшного тифа;
3-ья капля: - физиологический раствор (контроль).
Добавляют в каждую каплю исследуемую чистую культуру бактерий. Перемешивают.
Примечание: положительный результат - наличие хлопьев агглютината,
отрицательный - отсутствие хлопьев агглютината
Заключение: Исследуемые бактерии являются возбудителями брюшного тифа.
2. Учет результатов РНГА, поставленной с целью обнаружения ботулотоксина.
Возбудитель ботулизма - Clostridium botulinum вырабатывает токсины семи сероваров (А, B, C, D, E, F, G), однако чаще других встречаются серовары А, В, Е. Все токсины отличаются по антигенным свойствам и могут быть дифференцированы в реакциях типоспецифическими сыворотками. Для этой цели можно поставить реакцию пассивной (непрямой) гемагглютинации с сывороткой больного, в которой предполагается наличие токсина, и эритроцитами, нагруженными антителами антитоксических противоботулинических сывороток типов А, В, Е. Контролем служит нормальная сыворотка.
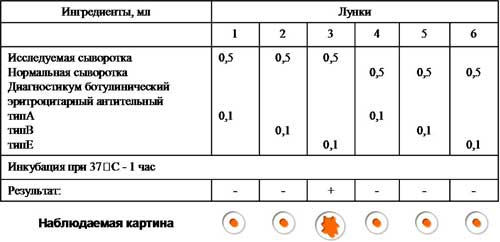
Рис. 3. Постановка и результат РНГА.
Учет. В положительном случае эритроциты оседают на дне лунки в виде ровного слоя клеток со складчатым или зазубренным краем (перевернутый зонтик), в отрицательном - оседают в виде пуговки или колечка.
Вывод: В сыворотке больного обнаружен ботулотоксин тип Е.
Реакция преципитации – это формирование и осаждение комплекса растворимого молекулярного антигена с антителами в виде помутнения, называемого преципитатом. Он образуется при смешивании антигенов и антител в эквивалентных количествах. Реакцию преципитации ставят в пробирках (реакция кольцепреципитации), в гелях, питательных средах и др.
3. Постановка и учет реакции кольцепреципитации для определения видовой принадлежности кровяного пятна.
Постановка. В узкую пробирку №1 диаметром 0,5 см с неразведенной преципитирующей сывороткой против белков крови человека в количестве 0,3-0,5 мл, держа ее в наклонном положении, пастеровской пипеткой медленно по стенке наслаивается такой же объем антигена (экстракт кровяного пятна). В пробирку №2 приливают преципитационную сыворотку против белков барана, в пробирку №3 - физиологический раствор (контроль) и добавляют также, как в первую пробирку антиген. Пробирки осторожно, чтобы не смешать жидкости, ставят вертикально. При правильном наслоении преципитиногена на сыворотку четко обозначается граница между двумя слоями жидкости. Постановка реакции обязательно сопровождается контролями сыворотки и антигена.
Учет. Результаты реакции учитывают в зависимости от вида антигена и антител через 5-10 мин, 1-2 ч или через 20-24 ч. В случае положительной реакции в пробирке на границе между сывороткой и исследуемым экстрактом появляется преципитат в виде кольца белого цвета.
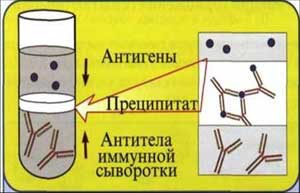
Рис. 4. Реакция кольцепреципитации.
4. Определение токсигенности коринебактерий дифтерии в реакции преципитации в агаре.
Эта издавна используемая реакция преципитации, предложенная для определения токсичности коринебактерий дифтерии, ставится на фосфатно-пептонном агаре в чашке Петри. Вдоль ее посередине помещают полоску стерильной фильтровальной бумаги, смоченной антитоксической сывороткой. После подсушивания на расстоянии 1 см от края полоски бляшками диаметром 10 мм подсевают выделенные культуры. В одной чашке можно сеять от 3 до 10 культур, одна из которых, контрольная, должна быть заведомо токсигенной. Посевы помещают в термостат.
Учет реакций проводят через 24-48-72 ч. Если культура токсигенная, на некотором расстоянии от полоски бумаги возникают линии преципитата, совпадающие с линиями преципитата контрольной культуры. Они имеют вид «стрел-усиков», которые хорошо видны в проходящем свете.
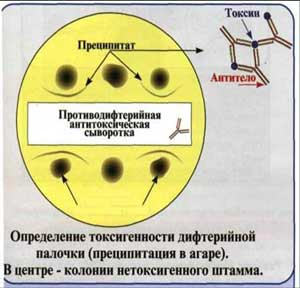
Рис. 5. Реакция преципитации в агаре.
ИММУНОЛОГИЧЕСКИЕ РЕАКЦИИ ВЫЯВЛЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ
5. Постановка непрямой реакции гемагглютинации (РНГА) выявления титра специфических антител у больного.
В реакции пассивной гемагглютинации (РПГА) в качестве носителя используют эритроциты. Нагруженные антигеном эритроциты склеиваются в присутствии специфических антител к данному антигену и выпадают в осадок. Сенсибилизированные антигеном эритроциты используют в РПГА как эритроцитарный диагностикум для обнаружения антител (серодиагностика).
Постановка. В лунках полистироловых планшетов готовят ряд последовательных разведений сыворотки. В предпоследнюю лунку вносят - 0,5 мл заведомо положительной сыворотки и в последнюю 0,5 мл физиологического раствора (контроли). Затем во все лунки добавляют по 0,1 мл разведенного эритроцитарного диагностикума, встряхивают и помещают в термостат на 2 ч.
Учет. В положительном случае эритроциты оседают на дне лунки в виде ровного слоя клеток со складчатым или зазубренным краем (перевернутый зонтик), в отрицательном - оседают в виде пуговки или колечка.

Рис. 6. Результат РНГА. Титр антител - 1:100.
6. Постановка развернутой реакции агглютинации с целью выявления титра специфических антител у больного.
Развернутая РА для серодиагностики ставится в сыворотке больных. Ее разводят и изотоническом растворе натрия хлорида от 1:50 - 1:100 до 1:800 или 1: 1600. Так как в более низких титрах сыворотки могут находиться нормальные агглютинины, имеющиеся у здоровых людей или больных с другим диагнозом (диагностический титр). В качестве антигена в этой реакции используют диагностикумы - заведомо известные взвеси, как правило, убитых бактерий, с которыми безопасно работать.
Ставят реакцию следующим образом. В агглютинационные пробирки предварительно разливают по 1 мл изотонического раствора натрия хлорида. В первую из них доливают 1 мл сыворотки, разведенной 1:100, и, смешав ее, 1 мл переносят во вторую, из второй - в третью и т.д. В полученные двухкратные разведения сывороток (от 1:100 до 1:1600 и более) вносят по 1-2 капли взвеси бактерий, содержащей 3 млрд микробных тел в 1 мл. Пробирки встряхивают и помещают в термостат при 37°С на 2 часа, затем сутки выдерживают при комнатной температуре.
Учет реакции развернутой агглютинации производят, оценивая последовательно каждую пробирку, начиная с контрольных, при осторожном встряхивании. В контрольных пробирках агглютинации не должно быть. Интенсивность реакции агглютинации отмечают следующими знаками: ++++ - полная агглютинация (хлопья агглютината в абсолютной прозрачной жидкости); +++ - неполная агглютинация (хлопья в слабоопалесцирующей жидкости); ++ - частичная агглютинация (хлопья четко различимы, жидкость слегка мутная); + - слабая, сомнительная агглютинация - жидкость очень мутная, хлопья в ней плохо различимы; — - отсутствие агглютинации (жидкость равномерно мутная).
За титр сыворотки принимают последнее ее разведение, в котором интенсивность агглютинации оценивается не менее чем два плюса (++)
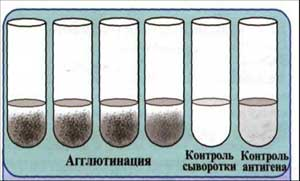
Рис. 7. Развернутая реакция агглютинации.
РЕАКЦИИ НЕЙТРАЛИЗАЦИИ
Реакции нейтрализации (РН) основаны на способности АТ связывать различные возбудители или их метаболиты, лишая тем самым их возможности реализовать свои биологические свойства (иными словами, АТ нейтрализуют возбудителей). На практике РН применяют для выявления вирусов и различных токсинов. В определенной степени к ним же относят реакции торможения вирусиндуцированной гемагглютинации и иммобилизации.
Реакция нейтрализации вирусов
В сыворотки крови переболевших лиц циркулируют антитела, нейтрализующие вирусы. Их наличие выявляют смешиванием культуры возбудителей с сывороткой с последующим введение лабораторному животному или заражением культуры клеток. На эффективность нейтрализации указывает выживание животного либо отсутствие гибели клеток в культурах.
7. Реакция торможения гемагглютинации (РТГА).
| 
|
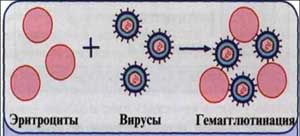
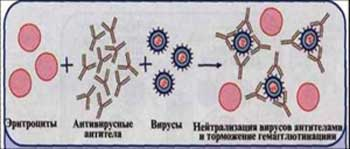
Рис. 8. Реакция торможения гемагглютинации (РТГА) (схема).
Принцип реакции основан на способности АТ связывать различные вирусы и нейтрализовать их, лишая возможности агглютинировать эритроциты. Визуально этот эффект и проявляется в «торможении» гемагглютинации. РТГА применяют при диагностике вирусных инфекций для выявления специфических антигемагглютининов и идентификации различных вирусов по их гемагглютининам, проявляющим свойства Аг.
Типирование вируса проводят в реакции РТГА с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса типа А с антигенами H0N1, H1N1, H2N2, H3N2 и другие могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток
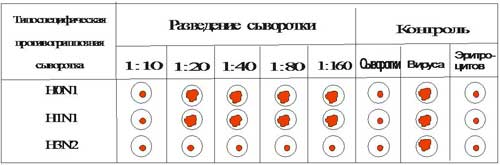
Рис. 9. Результаты РТГА при типировании вируса гриппа
Условные обозначения:  - торможение гемагглютинации (пуговка) ;
- торможение гемагглютинации (пуговка) ;  - гемагглютинация (зонтик).
- гемагглютинация (зонтик).
Выводы: Исследуемый материал содержит вирус гриппа тип А с антигеном H3N2
Определение титра антител крови больного по РТГА
Развернутая РТГА проводится в лунках пластмассовых пластин. В лунках готовят 2-х кратные разведения исследуемой сыворотки в объеме 0,25 мл, добавляют по 0,25 взвеси вируса в рабочем разведении и инкубируют 2 ч при температуре 37°С. Затем добавляют по 0,5 мл 1% взвеси куриных эритроцитов, инкубируют еще 2 ч и оценивают результат по феномену гемагглютинации.
При положительной РТГА образуется плотный осадок эритроцитов на дне лунки в виде диска или кольца с ровными краями. Титр антител определяют по последней лунке с положительной РТГА.

Рис. 10. Определение титра антител по РТГА.
Выводы: титр антител равен 1:40.
8. Результаты реакции нейтрализации выделенных от больных вирусов с моновалентными иммунными сыворотками к вирусам полиомиелита I-III типов.
Выделение энтеровирусов из исследуемого материала осуществляют путем заражения клеточных культур. Индикацию вирусов проводят по цитопатогеному действию (ЦПД): на 2-3-й день инкубации при 35°С наблюдается полная или частичная дегенерация клеток. Основным методом идентификации выделенного вируса является серотипирование в реакции нейтрализации. С этой целью материал из чистой культуры выделенного вируса обрабатывают смесью диагностических моновалентных сывороток к различным серотипам энтеровирусов. При этом в начале определяют тип вируса, затем его принадлежность к определенному серотипу.
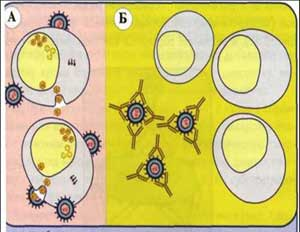
Рис. 11. Реакция нейтрализации вирусов в культуре клеток: А - цитопатогенный эффект (ЦПЭ) или цитопатогенное действие (ЦПД) в результате размножения вирусов; Б - ЦПЭ отсутствует в результате предварительной нейтрализации вирусов антителами.
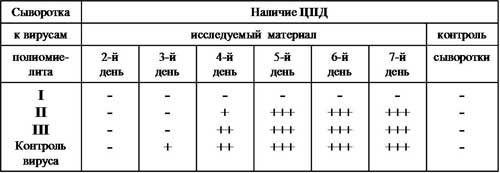
Рис. 12. Постановка и учет реакции нейтрализации вирусов в культкре клеток. Условные обозначения: + - ЦПД; – - отсутствие ЦПД.
Выводы: В исследуемом материале определен вирус полиомиелита серотип I.
Дата добавления: 2015-12-08; просмотров: 2182;
