Уравнения химических реакций
Для описания химических процессов (реакций) используются уравнения химических реакций. Уравнение химической реакции, прежде всего, показывает какие вещества были взяты для реакции и какие продукты получены. Каждая формула, входящая в уравнение, указывает точный состав веществ – в этом проявляется закон постоянства состава. Из уравнения химической реакции следует, что число атомов каждого вида до реакции равно числу атомов этого элемента после реакции. Так в уравнении отражается закон сохранения массы.
Запишем уравнение химической реакции в общем виде:
aA + bB = dD + fF
Вещества А и В называются исходными веществами,а вещества D и F – продуктами реакции.Коэффициенты a, b, d, f , которые расставляются для
уравнивания количества атомов в исходных веществах и продуктах реакции,
называются стехиометрическими (т.е. количественными).
Уравнения химических реакций позволяют производить количественные расчёты. Для количественных расчётов используются молярные массы реагирующих веществ, которые определяются по их формулам. Далее с помощью пропорции по уравнению можно производить любые расчёты.
Например, сколько (г) вещества (В) может прореагировать с m(г) вещества (А)? Запишем уравнение этой реакции
aA + bB = dD + fF
По формулам веществ (А) и (В) рассчитаем их молярные массы;: молярная масса вещества (А) равна M(A), а вещества (В) - M(B) . В реакции участвует (а) молей вещества (А), которые реагируют с (b) молями вещества (В). Это будет первая строчка пропорции, т.е. первая строчка пропорции вытекает из уравнения реакции. Вторая строчка пропорции вытекает из условия задачи: m(г) вещества (А) реагирует с (x) г вещества (В). В виде пропорции это будет выглядеть следующим образом:
aA + bB = dD + fF
а M(A), г в M(B),г
b M(B) г вещества (В) реагирует с а M(A) г вещества (А)
х г -------------------------- m г вещества (А)
Решая пропорцию, получаем:
х = 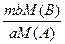
Таким образом, можно произвести любые количественные расчёты по уравнению химических реакций. 
Большинство химических реакций является сложными, т.е. состоят из нескольких последовательных стадий. Уравнение химической реакции ничего не говорит об отдельных стадиях или, как говорят, о механизме реакции. В ходе многих реакций не происходит полного превращения исходных веществ в продукты реакции, процесс как бы останавливается, в этом случае получается смесь начальных веществ с конечными продуктами реакции. В этом случае говорят, что реакция идёт до состояния равновесия, при котором скорости
прямой и обратной реакций становятся одинаковыми.В уравнении при этом вместо знака = пишут D:
aA + bB D dD + fF
Дата добавления: 2015-12-08; просмотров: 786;
