Энтальпия жидкости и пара
Напишем уравнение первого закона термодинамики для 1 кг тела в общем виде:
 q = (и2 – и1) + Аl ккал/кг. (5.6)
q = (и2 – и1) + Аl ккал/кг. (5.6)
Подведенное к телу количество теплоты затрачивается на изменение внутренней энергии и на совершение работы. А – коэффициент.
Для изобарного процесса можно записать l = p(v2 –v1) ( рис. 5.7).
Допустим, что 1 кг газа, имеющего удельный объем v1, заключен в цилиндр с поршнем, нагруженным грузом.
Если этот газ подогреть, не изменяя давления, то объем его, очевидно, увеличиться и в какой-нибудь момент станет равным v2. При расширении газ произведет внешнюю работу, которая выразится в поднятии поршня. Как известно, работа равна произведению силы на путь, т.е.
l = Q∙S,
где:
l – работа 1 кг газа при поднятии поршня с постоянным грузом;
Q – общее давление на поршень;
S – расстояние, на которое передвинулся поршень при совершении газом работы l.
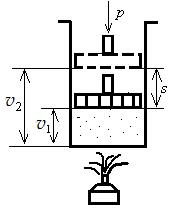
Рис. 5.7. К объяснению значения совершаемой работы
Если обозначим давление газа, приходящегося на 1 м2 площади поршня, через р, а площадь поршня через F м2, то общее давление Q на поршень будет равно pF. При этом l = p·F·S кгм/кг.
Но F·S – объем цилиндра, имеющего площадь основания F и высоту S. Обозначим этот объем через v (удельный объем газа).
Тогда l = p·F·S = p. v
Как видно из рис. 5.7, v = v2 – v1, а поэтому
l = p(v2 – v1) кгм/кг.
Тогда уравнение 5.6 можно записать
q = (и2 – и1) + А p(v2 – v1) кДж/кг.
Перегруппировывая члены в правой части уравнения, получим
q = (и2 + А pv2) – (и1 + А pv1) кДж/кг. (5.7)
Правая часть этого уравнения является разностью двух выражений, представляющих собой одну и ту же величину вида и + А p v. Эта величина называется э н т а л ь п и е й (теплосодержанием) и обозначается через h. Итак,
h = и + А p v.(5.8)
Как видим, энтальпия определяется тремя величинами: и, р и v, являющимися параметрами состояния рабочего тела. Следовательно, энтальпия тоже является параметром состояния и должна измеряться так же, как измеряются и и А p v, т.е. в килокалориях или килоджоулях. Все величины, входящие в уравнение (5.8), должны относится к одному состоянию тела. Например, если состояние его определяется точкой 1,
то h1 = и1 + А p v1 кДж/кг.
В дальнейшем мы увидим, что энтальпия позволяет значительно упрощать и сокращать расчеты, связанные с теплотой, вследствие чего этот параметр широко применяется в теплотехнических расчетах, в особенности в расчетах, относящихся к парам.
Если в уравнении (5.7) для изобарного процесса подставить величину h, то оно приобретает очень простой вид:
q = h2 – h1 кДж/кг.(5.9)
Значения i берутся из специальных таблиц или диаграмм, о которых будет сказано ниже.
Посмотрим, как вычисляют энтальпию для воды и пара (рис. 5.8).
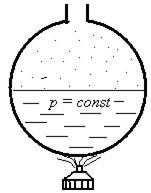
Рис. 5.8. К объяснению определения энтальпии воды и пара
При нагревании воды от 0 оС до температуры насыщения ts вода приобретает энтальпию 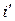 , называемой энтальпией кипящей жидкости. После чего начинается парообразование и получается влажный насыщенный пар, энтальпию которого можно определить по формуле
, называемой энтальпией кипящей жидкости. После чего начинается парообразование и получается влажный насыщенный пар, энтальпию которого можно определить по формуле
hх =h’+хr кДж\кг
При этом температура насыщения в сосуде остается постоянной, соответствующей давлению в сосуде. Парообразование происходит за счет величины r, называемой скрытой теплотой парообразования (см. ранее). Когда вся вода испарится, получается сухой насыщенный пар, степень сухости которого х равна 1. Энтальпия сухого насыщенного пара определится как:
h”= h’+r кДж/кг.
Нагревая далее сухой насыщенный пар и, повышая его температуру, получаем перегретый пар, энтальпию которого можно определить по формуле
h = h”+cpm(t – ts) кДж/кг.
где t – температура перегретого пара.
Дата добавления: 2015-09-07; просмотров: 3892;
