Теплота парообразования
Процесс получения перегретого пара при постоянном давлении можно разделить, как уже говорилось, на три стадии:
1) подогрев воды от 0 оС до температуры насыщения 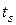 ;
;
2) превращение всего количества воды, подогретой до температуры насыщения 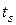 в сухой пар (стадия парообразования);
в сухой пар (стадия парообразования);
3) перегрев сухого пара от температуры 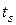 до любой температуры t (выше
до любой температуры t (выше 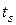 ).
).
Теплота, которую нужно сообщить 1 кг воды, взятой при 0 оС, чтобы довести ее при постоянном давлении до температуры насыщения, называется теплотой жидкости 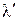 (первая стадия). Это количество теплоты может быть найдено по уравнению q = c(
(первая стадия). Это количество теплоты может быть найдено по уравнению q = c( 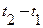 ) ккал/кг. Полагая в нем q =
) ккал/кг. Полагая в нем q = 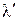 , с равным теплоемкости воды (при обычных практических условиях с = 1 ккал/кг∙град = 4,19 кДж/ кг∙град),
, с равным теплоемкости воды (при обычных практических условиях с = 1 ккал/кг∙град = 4,19 кДж/ кг∙град), 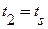 и
и 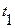 = 0о С, получим
= 0о С, получим
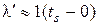 ,
,
или
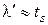 .
.
Теплота, которую нужно сообщить при постоянном давлении 1 кг воды, доведенной уже до температуры насыщения, чтобы превратить ее в сухой пар, называется теплотой парообразования r (вторая стадия). Как известно, при подводе или отводе этой теплоты температура воды не изменяется. Теплота парообразования складывается из внутренней теплоты парообразования ρ и внешней теплоты парообразования 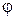 (греческая буква «пси»). Внутренняя теплота парообразования ρ есть та часть теплоты r, которая расходуется на преодоление молекулярных сил в жидкости, т.е. на увеличение ее внутренней энергии. Внешняя теплота парообразования
(греческая буква «пси»). Внутренняя теплота парообразования ρ есть та часть теплоты r, которая расходуется на преодоление молекулярных сил в жидкости, т.е. на увеличение ее внутренней энергии. Внешняя теплота парообразования 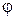 есть та часть теплоты r, которая затрачивается на работу преодоления внешних сил, действующих на жидкость. В результате совершения этой работы объем воды увеличивается от v’ до v”. Так как рассматриваемый процесс парообразования происходит при постоянном давлении р, то эта работа равна р(
есть та часть теплоты r, которая затрачивается на работу преодоления внешних сил, действующих на жидкость. В результате совершения этой работы объем воды увеличивается от v’ до v”. Так как рассматриваемый процесс парообразования происходит при постоянном давлении р, то эта работа равна р( 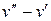 ) кгм/кг, а соответствующее ей количество теплоты
) кгм/кг, а соответствующее ей количество теплоты 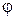 может быть выражено уравнением
может быть выражено уравнением
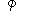 = А р(v”– v’) ккал/кг.
= А р(v”– v’) ккал/кг.
Таким образом, 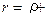 φ Подставляя в это уравнение значение для φ, можем написать
φ Подставляя в это уравнение значение для φ, можем написать
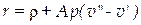 ккал/кг.
ккал/кг.
Теплота парообразования уменьшается с увеличением давления и при критическом давлении 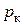 она равна нулю.
она равна нулю.
Большую часть теплоты r составляет внутренняя теплота парообразования 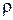 . Поэтому при изучении свойств водяных паров нельзя пренебрегать молекулярными силами, как это обычно делается при изучении газов (в последних, как известно, молекулярные силы настолько малы, что ими можно пренебрегать, полагая
. Поэтому при изучении свойств водяных паров нельзя пренебрегать молекулярными силами, как это обычно делается при изучении газов (в последних, как известно, молекулярные силы настолько малы, что ими можно пренебрегать, полагая 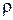 = 0).
= 0).
Теплота жидкости и теплота парообразования в сумме составляют полную теплоту сухого насыщенного пара 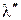 .
.
Математически это выражается уравнением
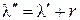 .
.
Или, зная, что
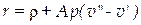 ккал/кг,
ккал/кг,
можно записать
 ккал/кг.
ккал/кг.
Из сказанного следует, что полной теплотой сухого насыщенного пара называется такое количество теплоты, которое нужно сообщить при постоянном давлении 1 кг воды, взятой при 0 оС, чтобы превратить ее в сухой насыщенный пар.
Если процесс превращения воды в пар не закончен, т.е. если имеется влажный пар степени сухости х, то количество теплоты, которое необходимо сообщить 1 кг воды, взятой при 0 оС, чтобы превратить ее при постоянном давлении во влажный пар, называется полной теплотой влажного пара 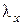 .Если степень сухости равна х, то:
.Если степень сухости равна х, то:
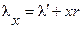 ккал/кг.
ккал/кг.
Количество теплоты, которое нужно сообщить 1 кг сухого насыщенного пара, чтобы превратить его при постоянном давлении в перегретый пар, называется теплотой перегрева 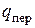 (третья стадия). Это количество теплоты может подсчитываться по уравнению
(третья стадия). Это количество теплоты может подсчитываться по уравнению
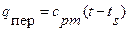 ккал/кг,
ккал/кг,
где:
t – температура перегретого пара;
ts – температура насыщения;
срm – средняя весовая изобарная теплоемкость перегретого пара в
пределах этих температур.
Теплоемкость перегретого водяного пара, в отличие от теплоемкости идеальных газов, зависит не только от температуры, но также и от давления пара. Значения этой теплоемкости приводятся в специальных таблицах.
Полная теплота сухого насыщенного пара и теплота перегрева в сумме составляют полную теплоту перегретого пара λ . Следовательно, λ = 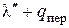 кКал/кг или, имея ввиду уравнение для
кКал/кг или, имея ввиду уравнение для 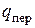 , можем написать, что
, можем написать, что
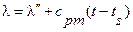 ккал/кг.
ккал/кг.
Таким образом, полной теплотой перегретого пара называется такое количество теплоты, которое нужно сообщить при постоянном давлении 1 кг воды, взятой при 0 оС, чтобы превратить ее в перегретый пар.
Дата добавления: 2015-09-07; просмотров: 2395;
