Теория растворов сильных электролитов.
Сильные электролиты в растворах полностью диссоциированы на ионы. Это достоверно установлено рядом физико-химических иссле-дований. Однако, в ходе некоторых экспериментов было отмечено, что величины электропроводности, значения изотонических коэф-фициентов и другие параметры оказывались несколько заниженными по сравнению с теоретически рассчитанными для условий 100%-й диссоциации.
Кажущееся противоречие объясняется в теории Дебая-Хюккеля. В основу данной теории был положен очевидный факт, что в концентрированных растворах сильных электролитов, вследствие их полной диссоциации, содержится значительно большее количество ионов по сравнению с растворами слабых электролитов. Это приводит к тому, что в растворах сильных электролитов наблюдается межионное взаимодействие, в результате которого вокруг каждого иона концентрируются ионы противоположного знака, образуя так называемую «ионную атмосферу». Как следствие, в растворах сильных электролитов реализуется ситуация, когда число кинетически самостоятельных ионов, участвующих в различных физико-химических процессах, несколько занижено по сравнению с общим числом ионов, образующихся при 100%-й диссоциации электролита. Таким образом, экспериментально определяемая степень диссоциации оказывается меньше 100% и потому она назы-ваетсякажущейся степенью диссоциации aK.
В этой связи было введено понятие активностиионов, которое отражает количество ионов, не занятых в межионныхвзаимо-действиях.
Активность иона а(X) связана с его концентрацией следующим соотношением:
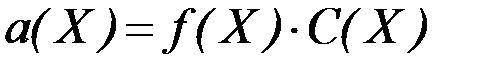 , ,
| (5) |
где а(X) – активность иона X, моль/л;
С(X) – молярная концентрация иона X, моль/л;
f(X) – коэффициент активности иона X.
Коэффициент активностиf(X) показывает степень отклонения раствора с концентрацией С(X) от поведения раствора при беско-нечном разбавлении.
В растворах сильных электролитов коэффициенты активности определяют при помощи предельного закона Дебая-Хюккеля:
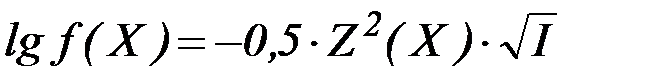
| (6) |
где 0,5 – множитель, учитывающий влияние температуры;
f(X) – коэффициент активности иона X;
Z(X) – заряд иона X;
I – ионная сила раствора.
Ионная сила раствора представляет собой полусумму произведений концентраций всех ионов раствора и квадратов их зарядов:
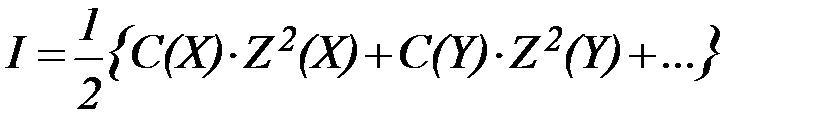
| (7) |
В бесконечно разбавленных растворах сильных электролитов концентрации ионов составляют величины, близкие к нулю, следовательно, I 0 и f(X) 1. В таких растворах а(X) »C(X).
С увеличением концентрации раствора значения коэффициента активности снижаются и в этом случае а(X) <C(X).
Следует отметить, что с помощью теории Дебая-Хюккеля удалось определить константы диссоциации сильных кислот. Действительно, считая величину 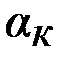 < 1, диссоциацию сильной кислоты HA можно представить как неполную:
< 1, диссоциацию сильной кислоты HA можно представить как неполную:
HA⇄H++A-,
а константу диссоциации выразить через активности ионов:
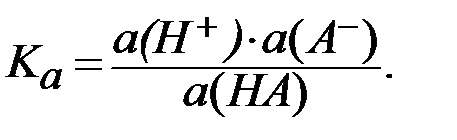
Величины констант диссоциации некоторых сильных кислот представлены в таблице 2. Приведенные значения 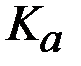 позволяют дать сравнительную оценку силы этих кислот.
позволяют дать сравнительную оценку силы этих кислот.
Таблица 2. Константы диссоциации некоторых сильных кислот при 298 К.
| кислота | 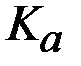
| кислота | 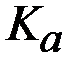
|
| HNO3 | 43,6 | HCl | 107 |
| HMnO4 | HBr | 109 | |
| H2SO4 | 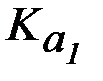 = 103 = 103
| HI | 1011 |
Дата добавления: 2015-10-30; просмотров: 999;
