Выражения концентрации растворов
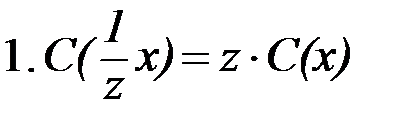
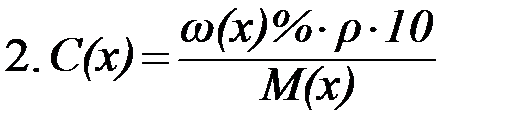
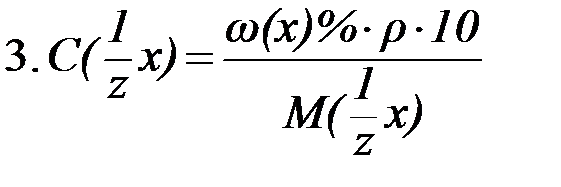
| 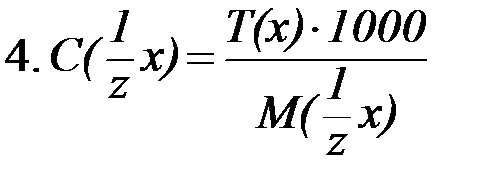
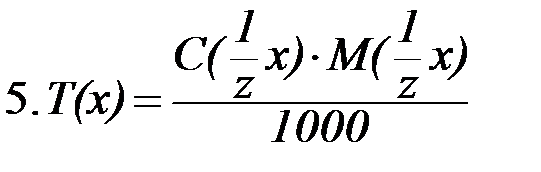
|
БЛОК ИНФОРМАЦИИ
Теория Электролитической диссоциации
Хорошо известно, что растворы могут приобретать некоторые качества, которые не наблюдаются ни у одного из компонентов, взятых в индивидуальном виде. Так, водный раствор NaCl хорошо проводит электрический ток, тогда как ни чистая вода, ни сухая соль электропроводностью не обладают. В этой связи все растворенные вещества принято делить на два типа:
1) вещества, растворы которых обладают электропроводностью, называют электролитами;
2) вещества, растворы которых не обладают электропро-водностью, называют неэлектролитами.
К неэлектролитам относятся оксиды, газы, большинство органи-ческих соединений (углеводороды, спирты, альдегиды, кетоны и др.).
К электролитам относится большинство неорганических и некоторые органические кислоты, основания и соли.
Появление электропроводности у растворов электролитов объяснил С. Аррениус, который в 1887 г. предложил теорию электролитической диссоциации:
Электролитической диссоциацией называется процесс распада электролита на ионы под действием молекул растворителя.
Главной причиной электролитической диссоциации является процесс сольватации (гидратации) ионов. Вследствие сольватации затрудняется обратный процесс рекомбинации ионов, называемый также ассоциацией или моляризацией.
В этой связи можно сформулировать некоторые положения:
1) диссоциации подвергаются вещества с ионным или близким к ионному типом химической связи;
2) процесс диссоциации сильнее протекает в полярном раство-рителе и слабее (если вообще возможен) в неполярном растворителе;
3) процесс диссоциации идет тем сильнее, чем выше диэлектри-ческая проницаемость растворителя.
В общем виде процесс электролитической диссоциации в воде можно представить следующим образом:
KtnAnm+ (x+y)H2O ⇄ n[Kt(H2O)x]m++ m[An(H2O)y]n-,
где Ktm+ – положительно заряженный ион (катион);
Ann- – отрицательно заряженный ион (анион).
Величины x и y, отражающие количество молекул воды в гидрат-ных оболочках, варьируются в широких пределах в зависимости от природы и концентрации ионов, температуры, давления и т.д. В этой связи удобнее пользоваться упрощенными уравнениями электроли-тической диссоциации, т.е. без учета гидратации:
NaCl Na++Cl-;
CuSO4 Cu2++ SO42-;
K3PO4 3K++PO43-.
Тем не менее, следует иметь в виду, что при диссоциации кислот в водных растворах образуются не свободные ионы H+, а достаточно устойчивые ионы гидроксонияH3O+, поэтому уравнение диссоциации кислоты (например, HCl) должно выглядеть так:
HCl+H2O H3O++Cl-.
Однако в химической литературе чаще встречается форма записи, отражающая только процесс распада электролита без учета эффекта гидратации. В дальнейшем мы также будем пользоваться упрощенной терминологией.
Дата добавления: 2015-10-30; просмотров: 1064;
