Виды выражения химического состава подземных вод.
Полезные, либо вредные свойства воды и ее пригодность для использования человеком можно определить исходя из рассмотрения растворенных в воде химических элементов и соединений.
Такое содержание в количественном выражении определяют в процессе выполнения химических анализов. Анализы подразделяют на общий анализ и специальные виды анализа.
Общий анализ , который также известен как стандартный, либо шестикомпонентный анализ, включает определение шести основных ионов: Cl-, SO42–, HCO3–, Ca2+, Mg2+, Na+, минерализации, плотности и рН воды.
Специальные виды анализа разнообразны. Их вид зависит от поставленной задачи. В поисковой нефтяной гидрогеологии, выполняют часто определение содержания J, Br, аммония, органических соединений, а также газовый состав, содержащийся в пробах воды.
Санитарный анализ выполняют чтобы определить пригодна ли вода в качестве питьевой, а также удовлетворяет ли она требованиям к воде для бытового использования. При этом определяют содержание ионов NH2+, NO2–, NO3– и окисляемость воды. В ряде случаев выполняют бактериологический анализ.
Бальнеологические анализы выполняют с тем, чтобы определить лечебные свойства воды. Как правило, такие анализы включают расширенный список дополнительных элементов, таких как определение содержания сульфидов, железа, мышьяка, лития, радиоактивности (например, содержание радона) и газовой составляющей.
Технические анализы выполняют с целью определить степень пригодности воды для технических нужд, таких как – для закачки вод в нефтяные пласты для вытеснения нефти, в котельных – для питания паровых котлов, для оценки других коррозионных (агрессивных) свойств воды.
Способы (формы) изображения химического состава воды.
На практике используют следующие формы отображения: весовая ионная, эквивалентная и процент-эквивалентная формы.
Весовая ионная форма – это выражение состава воды в виде весового количества отдельных ионов. При этом, содержание ионов (в миллиграммах, либо граммах) в единице объема, либо единице массы (обычно в 100 см3, 1000 см3, 100 г, 1 кг).
Если для пресных вод не имеет решающего значения, в каких единицах приведено это выражение, то для рассолов есть различие. Для выражения содержания растворенных газов в ряде веществ, находящихся в коллоидном состоянии, весовая ионная форма не используется.
Эквивалентная форма более точно учитывает химические свойства воды, позволяет контролировать точность результатов анализа и вычислять содержание ионов натрия и калия без прямого их аналитического определения.
Ионы, содержащиеся в растворе, реагируют между собой в количествах, определяемых весом и валентностью ионов (другими словами – в эквивалентных количествах). Как известно, эквивалентный вес (эквивалент) иона - это частное от деления ионного веса на его валентность. Так, эквивалент иона Са2+ равен 20 (40 : 2), а эквивалент иона SO42–, - 48 (96 : 2), или 20 весовых единиц иона Са2+ соответствует 48 весовым единицам иона SO42–.
Весовую ионную форму переводят в эквивалентную форму путем деления содержания ионов ( в мг, или г) на величину эквивалента иона. Можно также умножить содержание иона в весовой форме на коэффициент реакции (являющийся обратной величиной эквивалента этого иона).
Наличие перед химическим символом иона буквы r (например, rNa+, rCl– и т.д.) показывает, что содержание этого элемента выражено в эквивалентной форме.
Если же анионы и катионы даны в эквивалентной форме, то исходя из принципа электронейтральности раствора сумма анионов (Σra) должна быть всегда равна сумме катионов (Σrк)
Σra = Σrк
Тогда всегда можно определить содержание одного из шести ионов, если известны содержания других пяти. Тк, например иногда определяют содержание Na+:
rNa+ = (rCl–+ rHCO3–+ rSO42–) – (rCa2+ + rMg2+).
Чтобы определить содержание Na+в весовой ионной форме, полученную величину rNa+умножают на его эквивалент.
Процент-эквивалентная форма является модификацией эквивалентной формы и характеризует относительную долю каждого иона в общей сумме растворенных ионов, равную 100 %. Здесь сумма катионов и сумма анионов составляют по 50 %. Иногда принимают за 100 % сумму катионов (равной сумме анионов), при этом общее содержание ионов будет 200 %.
Содержание каждого иона в процентах от суммы всех ионов дает процент-эквивалентную форму отображения ионно-солевого состав воды.
Составив пропорции, где сумма всех ионов в эквивалентной форме равна (100% (или 200%), находим процентное содержание всех ионов последовательно:
Σ(а +к) – 100%,
i – x %,
Где Σ(а +к) – сумма ионов и катионов в эквивалентной форме; i – содержание искомого иона в эквивалентной форме; x – содержание искомого иона в процент-эквивалентной форме.
Заметим, что процент-эквивалентная форма не учитывает минерализацию воды. Это дает возможность сравнивать химический состав вод независимо от их степени минерализации.
В гидрогеологии используют три рассмотренные формы. Кроме того, чтобы кратко изобразить химический состав воды используют формулу М.ГЭ. Курлова. Она представляет собой сложную дробь. В числителе указывают содержание анионов, а в знаменателе – катионов в процент-эквивалентной форме. Ионы записывают по убывающим величинам. Перед дробью перечисляют основные компоненты состава растворенных газов и величину минерализации (г/дм3). За дробью приводят температуру, рН, содержание микрокомпонентов состава.
Например: 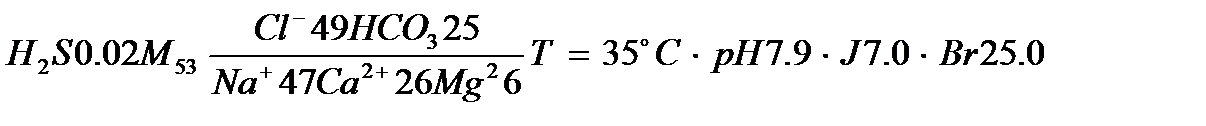
При этом, можно сказать, что состав воды следующий: сероводородная соленая вода гидрокарбонатно-хлоридного магниево-кальциево-натриевого состава имеет температуру 35 ˚С, слабощелочная, содержит йод (7.9 мг/дм3) и бром (25 мг/ дм3).
Ранее применяли характеристику Пальмера для определения характеристики воды нефтяных месторождений. Это определение воды по содержанию в ней тех или иных групп солей. Последние сочетаются из ионов по правилу Фрезениуса, утверждающей о том, что ионы соединяются между собой в порядке уменьшения химической активности. Последовательность степени активности основных ионов следующая: анионы – Cl–, SO42–, HCO3-, катионы – Na+, Mg2+, Ca2+.
Ионы Br-, J- располагаются за ионом Cl-; ионы H+, Fe3+, Al3+ - после иона Ca2+; ион HS– - после HCO3–; ион K+ - перед Na+; ион NH4+ - после Na+.
В соответствии с формулой Фрезениуса ион Cl– соединяется с ионом Na+, при избытке хлора его остаток затем соединяется с магнием, а в случае преобладания над ним – с кальцием; при избытке же натрия, его остаток соединяется с сульфат-ионом. Если натрий преобладает над сульфатом, то он (натрий) соединяется с гидрокарбонатом.
Пальмер выделил шесть солевых характеристик. Основное значение имеют: первая соленость (S1), вторая соленость (S2), первая щелочность (А1) и вторая щелочность (А2).
Графические методы изображения состава вод применяют для наглядного сравнения состава различных вод, а также – на картах и разрезах.
График Толстихина имеет круговую форму. Он используется для изображения состава отдельных проб воды в процент-эквивалентах. При этом, минерализация воды соответствует в выбранном масштабе радиусу круга. Он используется для вынесения единичных проб воды на карты. С его помощью можно изображать и состав растворенных и свободных газов.
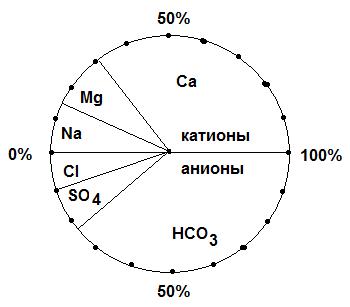
График Роджерса представляет собой 3 столбика одинаковой высоты. В крайних столбиках расположены ионы в порядке убывания их химической активности – левый столбик соответствует суммарному содержанию анионов, а правый – катионов. Вся высота столбика соответствует 50%-экв. Средний столбик отображает характеристику Пальмера. Его высота равна 100%-экв. Таким образом, график Роджерса изображает состав воды в процент-эквивалентной форме и позволяет легко графически находить характеристики Пальмера.
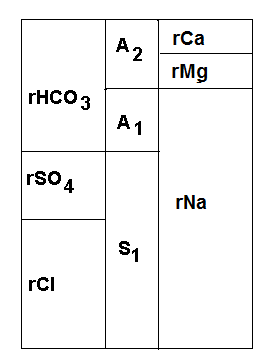
Метод «узоров» Стиффа. Он заключается в том, что содержание главных ионов (в миллиграмм-эквивалентной форме) откладывается в масштабе от общей оси. Концы отрезков, соединенных ломаной линией, образуют узор. От этого произошло его название.
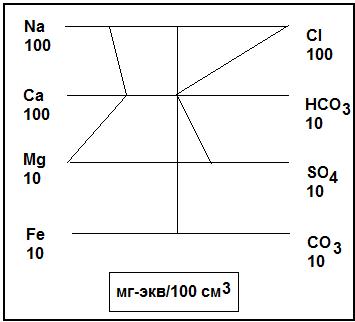
Полулогарифмическая диаграмма Шеллера – это график, по оси абсцисс которого отложены ионы, а по оси ординат – их содержание в миллиграмм-эквивалентах (в полулогарифмическом масштабе). Удобство заключается в том, что на одну диаграмму наносят ряд анализов воды, что позволяет сравнивать их между собой.
Наконец, любая гидрохимическая карта также представляет собой графическое изображение химического состава подземных вод.
Дата добавления: 2015-11-12; просмотров: 2734;
