Многоэлектронного атома
| Энерге-тический уровень n | Энергетический подуровень | Обозначение орбитали | Число орби-
талей
n 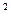
| Число электронов
2n 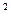
| |
| l | вид орбитали | ||||
| s | 1s | ||||
  2 2
| s p | 2s 2p | 3 4 | 2 8 | |
  3 3
| s p d | 3s 3p 3d | 3 9 | 6 18 | |
  4 4
| s p d f | 4s 4p 4d 4f | 3 16 | 6 32 |
Магнитное квантовое число ml в пределах данного подуровня (n, l = const) принимает все целочисленные значения от +l до –l, включая нуль. Для s-подуровня (n = const, l = 0) возможно только одно значение ml = 0, откуда следует, что на s-подуровне любого (от первого до седьмого) энергетического уровня содержится одна s-АО.
Для p-подуровня (n>1, l = 1) ml может принимать три значения +1, 0, -1, следовательно, на p-подуровне любого (от второго до седьмого) энергетического уровня содержится три p-АО.
Для d-подуровня (n>2, l = 2) ml имеет пять значений +2, +1, 0, -1, -2 и, как следствие, d-подуровень любого (от третьего до седьмого) энергетического уровня обязательно содержит пять d-АО.
Аналогично, для каждого f-подуровня (n>3, l = 3) m 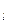 имеет семь значений +3, +2, +1, 0, -1, -2, -3 и поэтому любой f-подуровень содержит семь f-АО.
имеет семь значений +3, +2, +1, 0, -1, -2, -3 и поэтому любой f-подуровень содержит семь f-АО.
Таким образом, каждая атомная орбиталь однозначно определяется тремя квантовыми числами – главным n, орбитальным l и магнитным ml.
При n = const строго определены все относящиеся к данному энергетическому уровню значения l, а при l = const – все относящиеся к данному энергетическому подуровню значения ml.
Ввиду того, что каждая орбиталь может максимально заполняться двумя электронами, число электронов, которое может разместиться на каждом энергетическом уровне и подуровне, вдвое больше числа орбиталей на данном уровне или подуровне. Поскольку электроны, находящиеся в одной атомной орбитали, имеют одинаковые значения квантовых чисел n, l и ml, то для двух электронов на одной орбитали используется четвертое, спиновое квантовое число s, которое определяется спином электрона.
В соответствии с принципом Паули можно утверждать, что каждый электрон в атоме однозначно характеризуется своим набором четырех квантовых чисел – главного n, орбитального l, магнитного m и спинового s.
Заселение электронами энергетических уровней, подуровней и атомных орбиталей подчиняется следующему правилу (принцип минимума энергии): в невозбужденном состоянии все электроны обладают наименьшей энергией.
Это означает, что каждый из электронов, заполняющих оболочку атома, занимает такую орбиталь, чтобы атом в целом имел минимальную энергию. Последовательное квантовое возрастание энергии подуровней происходит в следующем порядке:
1s – 2s – 2p – 3s – 3p – 4s – 3d – 4p – 5s - …..
Заполнение атомных орбиталей внутри одного энергетического подуровня происходит в соответствии с правилом, сформулированным немецким физиком Ф. Хундом (1927 г.).
Дата добавления: 2015-10-26; просмотров: 737;
