Как заполняются электронные уровни, подуровни и орбитали по мере усложнения атома.
Если говорить более строго, то относительное расположение подуровней обусловлено не столько их большей или меньшей энергией, сколько требованием минимума полной энергии атома.
Распределение электронов по атомным орбиталям происходит, начиная с орбитали, имеющей наименьшую энергию (принцип минимума энергии), т.е. электрон садится на ближайшую к ядру орбиталь. Это значит, что сначала заполняются электронами те подуровни, для которых сумма значений квантовых чисел (n + l) была минимальной. Так энергия электрона на 4s-подуровне меньше энергии электрона, находящегося на 3d-подуровне. Следовательно, заполнение электронами подуровней происходит в следующем порядке: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d ~ 4f < 6p < 7s < 6d ~ 5f < 7p.
Исходя из этого требования, минимум энергии достигается у большинства атомов тогда, когда их подуровни заполняются в показанной выше последовательности. Но есть и исключения, которые вы можете найти в таблицах "Электронные конфигурации элементов", однако эти исключения редко приходится принимать во внимание при рассмотрении химических свойств элементов.
Атом хрома имеет электронную конфигурацию не 4s2 3d4, a 4s1 3d5. Это является примером того, как стабилизация состояний с параллельными спинами электронов преобладает над незначительной разницей энергетических состояний подуровней 3d и 4s (правила Гунда), то есть энергетически выгодными состояниями для d-подуровня являются d5 и d10 .Энергетические диаграммы валентных подуровней атомов хрома и меди представлены на рис.2.1.1.
Подобный переход одного электрона с s-подуровня на d-подуровень происходит еще у 8 элементов: Cu, Nb, Mo, Ru, Ag, Pt, Au. У атома Pdпроисходит переход двух s-электронов на d-подуровень: Pd 5s04d10.
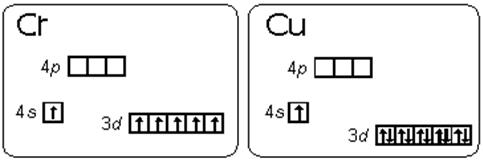
Рис.2.1.1. Энергетические диаграммы валентных подуровней атомов хрома и меди
Правила заполнения электронных оболочек:
1. Сначала выясняем, сколько всего электронов содержит атом интересующего нас элемента. Для этого достаточно знать заряд его ядра, который, всегда равен порядковому номеру элемента в Периодической таблице Д.И.Менделеева. Порядковый номер (число протонов в ядре) в точности равен и числу электронов во всем атоме.
2. Последовательно заполняем орбитали, начиная с 1s-орбитали, имеющимися электронами, учитывая принцип минимальной энергии. При этом нельзя располагать на каждой орбитали более двух электронов с противоположно направленными спинами (правило Паули).
3. Записываем электронную формулу элемента.
Атом – это сложная, динамически устойчивая микросистема взаимодействующих частиц: протонов р+, нейтронов n0 и электронов е-.
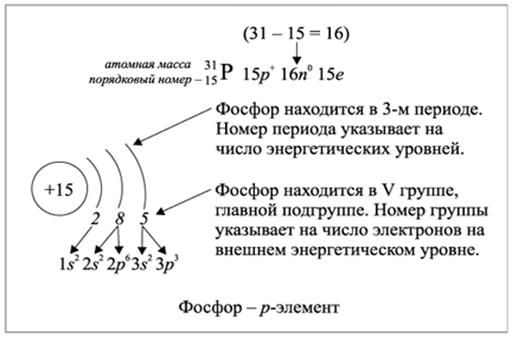
Рис.2.1.2. Заполнение энергетических уровней электронами элемента фосфора
Электронную структуру атома водорода (z=1) можно изобразить следующим образом:
+1Н 1s1 , n = 1 ↑, где квантовая ячейка (атомная орбиталь) обозначается в виде линии или квадрата, а электроны – в виде стрелок.
Каждый атом последующего химического элемента в периодической системе представляет собой многоэлектронный атом.
Атом лития, так же как и атом водорода и гелия, имеет электронную структуру s-элемента, т.к. последний электрон атома лития «садится» на s-подуровень:
+3Li 1s2 2s1 2p0
В атоме бора появляется первый электрон в p-состоянии:
+5В 1s2 2s2 2p1
Запись электронной формулы проще показать на конкретном примере. Допустим, нам надо выяснить электронную формулу элемента с порядковым номером 7. В атоме такого элемента должно быть 7 электронов. Заполним орбитали семью электронами, начиная с нижней 1s-орбитали.
Итак, 2 электрона расположатся на 1s-орбитали, еще 2 электрона - на 2s-орбитали, а оставшиеся 3 электрона смогут разместиться на трех 2p-орбиталях.
Электронная формула элемента с порядковым номером 7 (это элемент азот, имеющий символ “N”) выглядит так:
+7N 1s2 2s2 2p3
Рассмотрим действие правила Гунда на примере атома азота: N 1s2 2s2 2p3. На 2-м электронном уровне есть три одинаковых p-орбитали: 2px, 2py, 2pz. Электроны заселят их так, что на каждой из этих p-орбиталей окажется по одному электрону. Объясняют это тем, что в соседних ячейках электроны меньше отталкиваются друг от друга, как одноименно заряженные частицы. Полученная нами электронная формула азота несет очень важную информацию: 2-й (внешний) электронный уровень азота заполнен электронами не до конца (на нем 2 + 3 = 5 валентных электронов) и до полного заполнения не хватает трех электронов.
Внешним уровнем атома называется самый далекий от ядра уровень, на котором есть валентные электроны. Именно эта оболочка соприкасается при столкновении с внешними уровнями других атомов в химических реакциях. При взаимодействии с другими атомами азот способен принять 3 дополнительных электрона на свой внешний уровень. При этом атом азота получит завершенный, то есть максимально заполненный внешний электронный уровень, на котором расположатся 8 электронов.
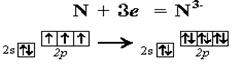
Завершенный уровень энергетически выгоднее незавершенного, поэтому атом азота должен легко реагировать с любым другим атомом, способным предоставить ему 3 дополнительных электрона для завершения его внешнего уровня.
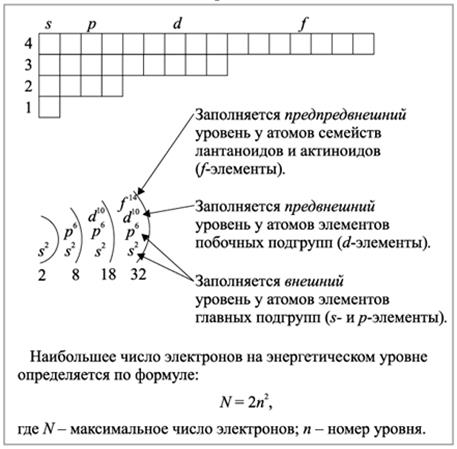
Рис.2.1.3. Заполнение энергетических уровней у s-, p-,d- и f- элементов электронами
Дата добавления: 2015-09-29; просмотров: 9170;
