N l me ms
11 3 0 0 – 1/2
12 3 0 0 +1/2
13 3 1 – 1 – 1/2
Существует условное изображение электронных уровней и подуровней, называемое орбитальной диаграммой. На такой диаграмме орбитали условно изображаются квадратиками или черточками, а электроны - стрелочками. Если стрелочки направлены в разные стороны, это означает, что электроны различаются между собой особым свойством, которое называется спином электрона.
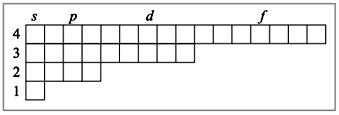
Данную систему можно назвать «гостиницей», в которую по одному «залетают» электроны и «поселяются» на определенный уровень n (1, 2, 3…), определенный подуровень (s, p, d, f). В одну «комнату» (орбиталь) может поселиться не более двух электронов (правило Паули). Поскольку s-комната (s-орбиталь) одна, то s-электронов максимум два (s2); p-комнат (p-орбиталей) – три, то p-электронов максимум шесть (p6); d-комнат (d-орбиталей) – пять, то d-электронов максимум десять (d10); f-комнат (f-орбиталей) – семь, то f-электронов максимум четырнадцать (f14). Заполнения электронов в пределах одного подуровня происходят согласно правилу Гунда - «сначала расселяем, а затем уплотняем». Согласно этому правилу электроны предпочитают расселяться на одинаковых по энергии орбиталях (например, на трех p-орбиталях) сначала по одиночке, и лишь когда в каждой такой орбитали уже находится по одному электрону, начинается заполнение этих орбиталей вторыми электронами. Когда орбиталь заселяется двумя электронами с противоположно направленными спинами, то такие электроны называют спаренными.
Во всех моделях атома электроны называют s-, p-, d- и f-электронами в зависимости от подуровня, на котором они находятся. Элементы, у которых внешние (то есть наиболее удаленные от ядра) электроны занимают только s-подуровень, принято называть s-элементами. Точно так же существуют p-элементы, d-элементы и f-элементы.
Дата добавления: 2015-09-29; просмотров: 878;
