ИЗУЧЕНИЕ СПЕКТРА АТОМА ВОДОРОДА
Квантовомеханический подход к изучению процессов поглощения света атомами позволяет их исследовать и объяснить. Состояние атома в квантовой механике описывается волновой функцией φn, его энергия Еn. В случае простейшего атома – атома водорода, состоящего из протона и электрона, квантовая механика позволяет получить точные решения волнового уравнения Шредингера (1).
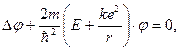
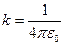 , (1)
, (1)
где m – масса электрона, е – его заряд, Е – полная энергия. Его решения для атома водорода дает набор дискретных уровней энергии. Для связанных состояний (Еn<0):
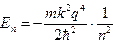 , (2)
, (2)
где 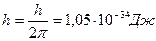 , n =1,2,3,…- главное квантовое число.
, n =1,2,3,…- главное квантовое число.
С ростом n уровни энергии атома сближаются, в пределе при n дискретный спектр приближается к непрерывному, а квантовая система к классической. Это и есть принцип соответствия Бора, который позволяет выразить постоянную Ридберга через фундаментальные постоянные. Для простоты Бор принял, что в атоме водорода электроны вращаются вокруг протона по окружности радиусом r с циклической частотой ω:
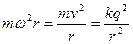 , (3)
, (3)
Согласно правилу квантования момента импульса электрона в атоме:
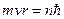 (4)
(4)
Решение (3), (4) дает выражение для радиусов круговых орбит электронов в атоме водорода:
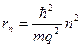 , (5)
, (5)
а также выражение (2).
Таким образом, при переходе атома водорода из состояния n2 c энергией Е2 в состояние n1 с энергией Е1 действует правило частот Бора:
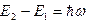 , (6)
, (6)
то есть испускается фотон с частотой ω и длиной волны λ:
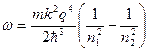 , (7)
, (7)
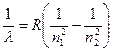 , (8)
, (8)
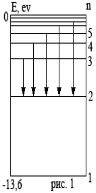
Формула (8) называется формулой Бальмера-Ритца. В этой формуле с увеличением n2 разность между волновыми числами 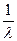 уменьшается, стремясь при n2 к предельному значению (для n1 = 2,
уменьшается, стремясь при n2 к предельному значению (для n1 = 2, 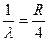 ). При этом линии сближаются, и уменьшается их интенсивность. Совокупность спектральных линий, закономерно меняющих свою интенсивность, называют спектральной серией. Предельное волновое число при n2 называется границей серии. Визуально мы можем наблюдать только серию Бальмера: для водорода – n1 = 2, n2 = 3,4,5…(рис.1).
). При этом линии сближаются, и уменьшается их интенсивность. Совокупность спектральных линий, закономерно меняющих свою интенсивность, называют спектральной серией. Предельное волновое число при n2 называется границей серии. Визуально мы можем наблюдать только серию Бальмера: для водорода – n1 = 2, n2 = 3,4,5…(рис.1).
Дата добавления: 2015-09-07; просмотров: 867;
