Существо метода
Рассмотренный выше электрофорез белков в простой систе-
ме удобно использовать для их разделения, но не для характери-
стики. Электрофоретическая подвижность каждого белка в про-
стой системе зависит одновременно и от его суммарного заряда,
и от молекулярной массы, и от конфигурации, и, наконец, от
жесткости упаковки полипептидной цепи. Вклад каждого из этих
факторов неизвестен и может существенно изменяться в зави-
симости от условий электрофореза. Для установления строгой
количественной корреляции между каким-либо одним из пере-
численных параметров и электрофоретической подвижностью
белка надо исключить влияние всех остальных.
Электрофорез в ПААГ с использованием ДДС-Na позволяет
фракционировать белки в зависимости от значений только од-
ного параметра — их молекулярной массы. Для этого белки в
исходном растворе препарата обрабатывают не менее чем трех-
кратным избытком ДДС-Na. За счет гидрофобных взаимодей-
ствий детергент примерно одинаково связывается с подавляю-
щим большинством белков в соотношении 1,4 мг ДДС-Na на
1 мг белка [Reynolds, Tanford, 1970]. Огромный избыток пол-
ностью диссоциированных остатков сульфокислоты, привноси-
мых с детергентом, в большинстве случаев делает несуществен-
ной роль собственного заряда белка. Постоянство соотношения
детергент/белок делает практически одинаковым отношение от-
рицательного заряда к массе для любого белка, даже для гисто-
нов с их заметным собственным положительным зарядом. Бла-
годаря электрическому отталкиванию
тесно расположенных по поверхности
белка остатков серной кислоты поли-
пептидная цепочка распрямляется и
приобретает форму жесткого эллипсои-
да вращения. Его малая ось имеет дли-
ну 1,6 нм, а размер большой линейно
связан с числом аминокислотных остат-
ков, а следовательно, с молекулярной
массой белка. Это справедливо лишь
для неразветвленных полипептидов, ли-
шенных дисульфидных мостиков, поэ-
тому одновременно с обработкой ДДС-
Na необходимо обеспечить полную де-
натурацию белка и разрыв всех S—S-
связей. С этой целью белковый препа-
рат обрабатывают высокой концентра-
цией b-меркаптоэтанола при повышен-
ной температуре.
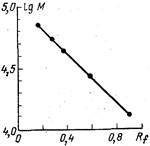
|
| Рис. 18. Линейная зависи- мость логарифма молеку- лярной массы (IgM) от от- носительного расстояния миграции белков (Rf) при электрофорезе в ПААГ |
Электрофоретическая подвижность
(и') жесткого комплекса белок — ДДС-Na оказывается связан-
ной с молекулярной массой белка (М) простым соотношением:
и'=А — В lg М, где А и В — коэффициенты, зависящие от порис-
тости геля, температуры и других условий эксперимента. Вели-
чину и' удобнее представлять в относительных единицах, выра-
жающих отношение путей миграции белка и бромфенолового
синего за время электрофореза, т. е. в значениях введенной ра-
нее величины Rf. Такая замена отразится только на значениях
коэффициентов А и В. Нет смысла определять эти коэффициенты
в каждом опыте. Одновременно с фракционированием исследуе-
мой смеси можно провести электрофорез набора белков-«марке-
ров», молекулярные массы которых точно известны. Разумеется,
вся предварительная обработка ДДС-Na и меркаптоэтанолом
должна быть строго одинаковой для исследуемого препарата и
маркеров. При электрофорезе в пластине для смеси маркеров
можно отвести отдельный трек. При использовании трубок мар-
керы лучше добавить прямо в препарат, так как нельзя гаран-
тировать строгой идентичности условий электрофореза в двух
разных трубках.
По окончании электрофореза, измерив пути миграции бром-
фенолового синего и каждого из маркеров, можно рассчитать
значения Rf и, зная молекулярные массы маркеров, построить
экспериментальную зависимость lg M от Rf для данного опыта.
Если пористость геля выбрана удачно (см. ниже), такая зави-
симость получается линейной (рис. 18). Определив теперь rf
для интересующего нас белка, из графика можно найти для него
величину lg M и подсчитать M. Положение и наклон прямой
на графике изменяются при вариации концентрации ПААГ и
других условий эксперимента, поэтому нельзя пользоваться ка-
кой-либо стандартной калибровкой. График зависимости Ig M
от Rf надо строить для каждого опыта. Отметим также, что при
определении Rf надо вводить поправки на набухание или съежи-
вание геля при фиксации, окраске белков и удалении красителя,
приводя все к исходному линейному размеру.
Метод определения молекулярной массы белков электрофоре-
зом в ПААГ с ДДС-Na завоевал себе прочную репутацию и ис-
пользуется очень широко. Тем не менее следует проявлять из-
вестную осторожность. Исследуемый белок может оказаться
принадлежащим к той, по-видимому, сравнительно немногочис-
ленной, категории белков, для которой количественное соотно-
шение в комплексе с ДДС-Na существенно отличается от 1 : 1,4.
Есть данные о том, что на полноту комплексообразования с
ДДС-Na может влиять распределение зарядов по полипептид-
ной цепочке. Показано, например, что обработка рибонуклеазы
малеиновой кислотой снижает количество связывающегося с ней
ДДС-Na с 1,9 до 0,3 г на 1 г белка. Такая обработка не изме-
няет заметным образом молекулярной массы рибонуклеазы, но
вносит отрицательный заряд карбоксила на место положитель-
ного заряда аминогруппы. С другой стороны, на связывании
ДДС-Na с лизоцимом обработка малеиновой кислотой никак не
сказывается [Tung, Knight, 1972]. Ненормальное связывание
ДДС-Na может быть также обусловлено необычной обогащен-
ностью белка какой-либо гидрофильной аминокислотой. Глико-
протеиды хуже связываются с ДДС-Na, чем чистые белки.
Разной степенью связывания ДДС-Na, по-видимому, следует
объяснить и успешное разделение a- и b-цепей глобина кролика
электрофорезом в 12,5%-ном ПААГ с ДДС-Na. Различие моле-
кулярных масс этих цепей (15 419 и 16 000) вряд ли само по
себе могло бы обеспечить это разделение (Wood, Shaeffer, 1975].
Недавно было показано, что единственная мутационная замена
аминокислоты (Арг®Цис) в белке с молекулярной массой 26 000
приводит к кажущемуся изменению этой величины на 1000. Су-
щественно отметить, что такое изменение связано с заменой
только одного из нескольких остатков аргинина, входящих в со-
став белка. Следовательно, в этом случае играет роль еще и
окружение аргинина [Noel et al., 1979].
Рассмотренные примеры не могут дискредитировать плодо-
творный метод определения молекулярной массы белков элект-
рофорезом с участием ДДС-Na. Они лишь указывают на необхо-
димость некоторой осторожности и критичности в оценке ре-
зультатов эксперимента, особенно с малоизученными белками.
Дата добавления: 2015-10-21; просмотров: 738;
