Второй закон Рауля
Растворы неэлектролитов замерзают при более низкой температуре, а кипят при более высокой температуре, чем чистый растворитель.
Второй закон Рауля:понижение температуры замерзания 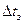 и повышение температуры кипения
и повышение температуры кипения 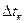 раствора пропорциональны моляльной концентрации растворенного вещества
раствора пропорциональны моляльной концентрации растворенного вещества 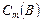 .
.
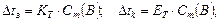
где 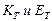 - криоскопическая и эбулиоскопическая константы соответственно,
- криоскопическая и эбулиоскопическая константы соответственно, 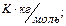
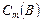 - моляльная концентрация раствора,
- моляльная концентрация раствора, 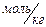 .
.
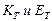 являются характеристикой растворителя и не зависят от природы растворенного вещества.
являются характеристикой растворителя и не зависят от природы растворенного вещества.
Пример 15. На сколько градусов понизится температура замерзания раствора, содержащего 1,15 г ацетамида 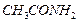 в 150 г воды? Криоскопическая константа воды равна 1,86.
в 150 г воды? Криоскопическая константа воды равна 1,86.
Решение: Определим моляльную концентрацию ацетамида в растворе по формуле:
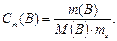
Молярная масса ацетамида 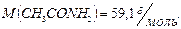
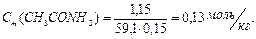
Теперь вычислим, на сколько градусов понизится температура замерзания раствора:
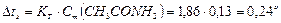 .
.
Пример 16. Вычислите массовую долю нафталина 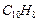 в бензоле, если известно, что этот раствор кипит при 82,5 °С. Температура кипения бензола равна 80,1 °С, эбулиоскопическая константа бензола равна 2,53
в бензоле, если известно, что этот раствор кипит при 82,5 °С. Температура кипения бензола равна 80,1 °С, эбулиоскопическая константа бензола равна 2,53 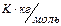 .
.
Решение: Повышение температуры кипения раствора составит 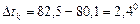 .
.
Обозначим за 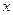 массу нафталина в 100 г раствора. Тогда масса растворителя (бензола) будет
массу нафталина в 100 г раствора. Тогда масса растворителя (бензола) будет 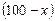 г или
г или 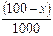 кг. Молярная масса нафталина
кг. Молярная масса нафталина 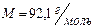 .
.
Подставив эти выражения в формулу для определения 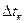 , получим:
, получим:
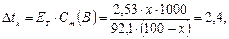
отсюда
определим, что 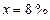 , а массовая доля - 0,08.
, а массовая доля - 0,08.
Дата добавления: 2015-10-19; просмотров: 920;
