Степень диссоциации. Константа диссоциации слабого электролита
Экспериментально было установлено, что законы Рауля и принцип Вант-Гоффа не выполняются для растворов, которые проводят электрический ток – растворов электролитов. Обобщая полученные в ходе исследований данные, Я.Г. Вант-Гофф пришел к выводу, что растворы электролитов ведут себя так, будто они содержат больше частиц растворенного вещества, чем следует из их концентрации: экспериментально установленные для них значения повышения температуры кипения, понижения температуры замерзания, осмотического давление всегда больше, чем вычисленные по соответствующим уравнениям. Для учета этих отклонений Вант-Гофф внес в уравнение 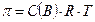 для растворов электролитов поправку – изотонический коэффициент
для растворов электролитов поправку – изотонический коэффициент 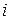 :
:
 .
.
Аналогичная поправка вносится и в законы Рауля:
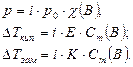
Изотонический коэффициент определяется следующим образом:
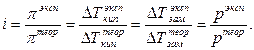
Изотонический коэффициент 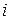 для растворов электролитов всегда больше единицы. Изотонический коэффициент показывает, во сколько раз общее число молекул и ионов в растворе больше числа молекул до диссоциации.
для растворов электролитов всегда больше единицы. Изотонический коэффициент показывает, во сколько раз общее число молекул и ионов в растворе больше числа молекул до диссоциации.
Для объяснения особенностей свойств растворов электролитов С. Аррениус предложил теорию электролитической диссоциации, основывающуюся на следующих постулатах:
1. Электролиты в растворах распадаются на ионы –
диссоциируют.
2. Диссоциация является обратимым равновесным
процессом.
3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными).
Для оценки полноты диссоциации в теории электролитической диссоциации вводится понятие степень диссоциации 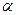 , которая равна отношению числа молекул
, которая равна отношению числа молекул  , распавшихся на ионы, к общему числу молекул
, распавшихся на ионы, к общему числу молекул  :
:
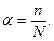
Величина степени диссоциации зависит от природы растворителя и растворенного вещества, концентрации раствора и температуры. По величине степени диссоциации электролиты подразделяются на три группы: сильные 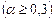 , средней силы
, средней силы 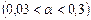 и слабые
и слабые 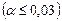 . К сильным электролитам относятся почти все растворимые соли (кроме
. К сильным электролитам относятся почти все растворимые соли (кроме 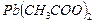 ,
, 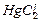 ,
, 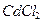 ), большинство неорганических кислот и щелочей (табл. 1); к слабым – все органические кислоты, вода,
), большинство неорганических кислот и щелочей (табл. 1); к слабым – все органические кислоты, вода, 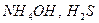 и т.д. Электролитами средней силы являются некоторые неорганические кислоты:
и т.д. Электролитами средней силы являются некоторые неорганические кислоты: 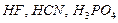 .
.
Талица 1
Сильные электролиты
| Кислоты | Основания | Соли |
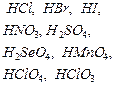
| 
| Растворимые в воде соли (см. таблицу растворимости) |
Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия, называемой константой диссоциации. Для некоторого электролита 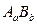 , распадающегося в растворе на ионы в соответствии с уравнением
, распадающегося в растворе на ионы в соответствии с уравнением
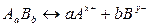 ,
,
константа диссоциации выразится следующим соотношением:
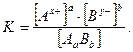
Для бинарного (распадающегося на два иона) электролита константа диссоциации равна:
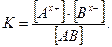
Поскольку концентрация каждого иона равна произведению степени диссоциации 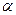 на общую концентрацию электролита
на общую концентрацию электролита 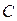

а концентрация в растворе непродиссоциировавших молекул 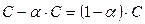 , то выражение для константы диссоциации в этом случае можно переписать следующим образом:
, то выражение для константы диссоциации в этом случае можно переписать следующим образом:
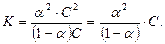
Для слабых электролитов степень диссоциации 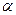 мала
мала 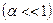 , поэтому можно считать, что
, поэтому можно считать, что  . Тогда получаем:
. Тогда получаем:
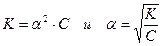
Таким образом, степень диссоциации слабого электролита обратно пропорциональна концентрации и прямо пропорциональна разбавлению раствора; выражение 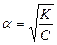 называют законом разбавления Оствальда. Степень диссоциации слабого электролита
называют законом разбавления Оствальда. Степень диссоциации слабого электролита 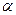 можно связать с изотоническим коэффициентом
можно связать с изотоническим коэффициентом 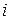 . Будем считать, что из
. Будем считать, что из 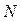 молекул электролита продиссоциировало
молекул электролита продиссоциировало  молекул, образовав
молекул, образовав  ионов (
ионов ( 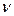 – число ионов, на которое диссоциирует молекула). Поскольку изотонический коэффициент показывает, во сколько раз общее число молекул и ионов в растворе больше числа молекул до диссоциации, получаем:
– число ионов, на которое диссоциирует молекула). Поскольку изотонический коэффициент показывает, во сколько раз общее число молекул и ионов в растворе больше числа молекул до диссоциации, получаем:
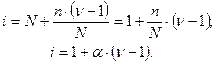
Соотношение 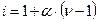 дает возможность, экспериментально определив изотонический коэффициент раствора, рассчитать степень диссоциации слабого электролита:
дает возможность, экспериментально определив изотонический коэффициент раствора, рассчитать степень диссоциации слабого электролита:
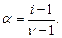
Дата добавления: 2015-10-19; просмотров: 2830;
