Вычисления, связанные со смещением равновесия диссоциации слабого электролита
Пример 21. Вычислите степень диссоциации и концентрацию 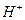 в 0,2 М растворе
в 0,2 М растворе 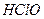 , если
, если 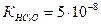 . Во сколько раз изменится концентрация
. Во сколько раз изменится концентрация 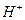 , если к 1 л 0,2 М раствора
, если к 1 л 0,2 М раствора 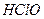 добавить 0,1 моль
добавить 0,1 моль 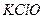 , считая его диссоциацию полной.
, считая его диссоциацию полной.
Решение:
1) Степень диссоциации 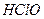 равна
равна
.
2) Начальная концентрация ионов 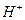 в 0,2 М растворе
в 0,2 М растворе
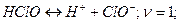
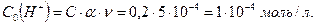
3) Находим концентрацию ионов 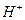 в присутствии гипохлорита калия
в присутствии гипохлорита калия 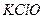 . Введение в раствор хлорноватистой кислоты
. Введение в раствор хлорноватистой кислоты 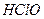 гипохлорита калия уменьшит концентрацию ионов
гипохлорита калия уменьшит концентрацию ионов 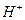 за счет увеличения концентрации ионов
за счет увеличения концентрации ионов 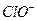 . Обозначим новую концентрацию
. Обозначим новую концентрацию 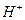 через
через 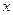 . Тогда концентрация недиссоциированных молекул равна
. Тогда концентрация недиссоциированных молекул равна 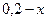 . Концентрация анионов
. Концентрация анионов 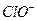 слагается из двух величин: из концентрации
слагается из двух величин: из концентрации 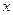 , создаваемой диссоциацией хлорноватистой кислоты, и концентрации, обусловленной диссоциацией прибавленной соли (0,1 моль/л), т.е.
, создаваемой диссоциацией хлорноватистой кислоты, и концентрации, обусловленной диссоциацией прибавленной соли (0,1 моль/л), т.е. 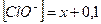 .
.
Подставив значения концентраций в выражение константы диссоциации хлорноватистой кислоты 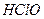 , получим:
, получим:
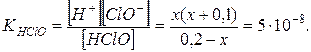
Поскольку величина 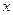 мала по сравнению с 0,1 и 0,2, то ею можно пренебречь. Тогда получим:
мала по сравнению с 0,1 и 0,2, то ею можно пренебречь. Тогда получим:
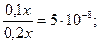
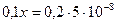 ;
; 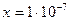 моль/л.
моль/л.
Концентрация [ 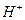 ] =
] = 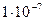 моль/л в присутствии
моль/л в присутствии 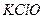 .
.
4) Находим, во сколько раз уменьшилась концентрация [ 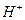 ] после прибавления гипохлорита калия:
] после прибавления гипохлорита калия:
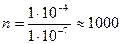 раз.
раз.
Дата добавления: 2015-10-19; просмотров: 1047;
